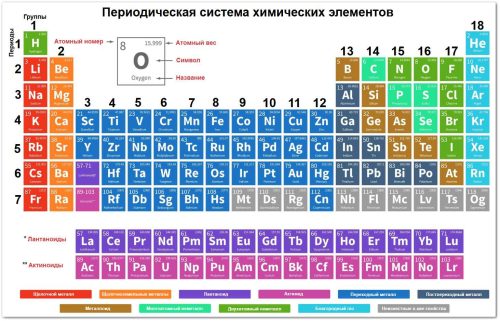
Теория:
Периодическая система химических элементов — это графическое выражение Периодического закона, который является основой всей химии.
Положение элемента в таблице не случайно; оно напрямую определяет его строение и химические свойства.
Современная формулировка закона: «Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений, находятся в периодической зависимости от заряда ядер их атомов (или порядкового номера Z)».
Периодическая система (таблица Менделеева) состоит из периодов (горизонтальных рядов) и групп (вертикальных столбцов).
Периоды (горизонтальные ряды)
Всего в системе 7 периодов.
Номер периода численно равен количеству энергетических уровней (слоёв) в атоме элемента.
Начало периода: Все периоды, кроме первого, начинаются со щелочного металла (сильного восстановителя). Первый период начинается с водорода.
Конец периода: Каждый период заканчивается инертным (благородным) газом (самым слабым окислителем, с заполненным внешним слоем).
✅ Закономерности в периоде (слева направо):
- Атомный радиус уменьшается.
- Неметаллические свойства и электроотрицательность усиливаются.
- Металлические свойства ослабевают.
- Степень окисления в высших оксидах возрастает от +1 до +7 (для Os и Ru — до +8).
- Оксиды меняются от основных через амфотерные к кислотным.
- Гидроксиды меняются от щелочей через амфотерные к кислотам.
Группы (вертикальные столбцы)
В системе 18 групп (в короткопериодной таблице — 8 групп с главными и побочными подгруппами).
Элементы, объединённые в одну группу, имеют сходные химические свойства.
Номер группы (для главных подгрупп A): равен числу валентных электронов на внешнем уровне атома.
Главная подгруппа (А): включает s- и p-элементы малых и больших периодов. Внутри подгруппы свойства наиболее схожи.
Побочная подгруппа (Б): включает d-элементы (переходные металлы) больших периодов.
✅ Закономерности в группе (сверху вниз):
- Атомный радиус увеличивается.
- Металлические свойства и восстановительные свойства усиливаются.
- Неметаллические свойства и электроотрицательность ослабевают.
- Основные свойства оксидов и гидроксидов усиливаются, кислотные — ослабевают.
- Кислотные свойства водородных соединений неметаллов усиливаются.
Связь положения и свойств (ключевые выводы)
Положение элемента в Периодической системе позволяет предсказать его основные характеристики:
- атомный радиус;
- электроотрицательность;
- металлические и неметаллические свойства;
- степени окисления;
- типы химических связей.
➡️ Дополнительные уточнения:
В короткопериодной таблице лантаноиды и актиноиды вынесены в отдельные ряды под основной таблицей.
В длиннопериодной таблице группы обозначаются арабскими цифрами, в короткопериодной — римскими с буквами A/B.
Диагональное сходство: некоторые элементы, расположенные диагонально (например, литий и магний), имеют близкие свойства из-за схожести атомных радиусов.
Все химические элементы в таблице Менделеева
- Водород в т. М.
- Гелий в т. М.
- Литий в т. М.
- Бериллий в т. М.
- Бор в т. М.
- Углерод в т. М.
- Азот в т. М.
- Кислород в т. М.
- Фтор в т. М.
- Неон в т. М.
- Натрий в т. М.
- Магний в т. М.
- Алюминий в т. М.
- Кремний в т. М.
- Фосфор в т. М.
- Сера в т. М.
- Хлор в т. М.
- Аргон в т. М.
- Калий в т. М.
- Кальций в т. М.
- Скандий в т. М.
- Титан в т. М.
- Ванадий в т. М.
- Хром в т. М.
- Марганец в т. М.
- Железо в т. М.
- Кобальт в т. М.
- Никель в т. М.
- Медь в т. М.
- Цинк в т. М.
- Галлий в т. М.
- Германий в т. М.
- Мышьяк в т. М.
- Селен в т. М.
- Бром в т. М.
- Криптон в т. М.
- Рубидий в т. М.
- Стронций в т. М.
- Иттрий в т. М.
- Цирконий в т. М.
- Ниобий в т. М.
- Молибден в т. М.
- Технеций в т. М.
- Рутений в т. М.
- Родий в т. М.
- Палладий в т. М.
- Серебро в т. М.
- Кадмий в т. М.
- Индий в т. М.
- Олово в т. М.
- Сурьма в т. М.
- Теллур в т. М.
- Йод в т. М.
- Ксенон в т. М.
- Цезий в т. М.
- Барий в т. М.
- Лантан в т. М.
- Церий в т. М.
- Празеодим в т. М.
- Неодим в т. М.
- Прометий в т. М.
- Самарий в т. М.
- Европий в т. М.
- Гадолиний в т. М.
- Тербий в т. М.
- Диспрозий в т. М.
- Гольмий в т. М.
- Эрбий в т. М.
- Тулий в т. М.
- Иттербий в т. М.
- Лютеций в т. М.
- Гафний в т. М.
- Тантал в т. М.
- Вольфрам в т. М.
- Рений в т. М.
- Осмий в т. М.
- Иридий в т. М.
- Платина в т. М.
- Золото в т. М.
- Ртуть в т. М.
- Таллий в т. М.
- Свинец в т. М.
- Висмут в т. М.
- Полоний в т. М.
- Астат в т. М.
- Радон в т. М.
- Франций в т. М.
- Радий в т. М.
- Актиний в т. М.
- Торий в т. М.
- Протактиний в т. М.
- Уран в т. М.
- Нептуний в т. М.
- Плутоний в т. М.
- Америций в т. М.
- Кюрий в т. М.
- Берклий в т. М.
- Калифорний в т. М.
- Эйнштейний в т. М.
- Фермий в т. М.
- Менделевий в т. М.
- Нобелий в т. М.
- Лоуренсий в т. М.
- Резерфордий в т. М.
- Дубний в т. М.
- Сиборгий в т. М.
- Борий (Bh) в т. М.
- Хассий в т. М.
- Мейтнерий в т. М.
- Дармштадтий в т. М.
- Рентгений в т. М.
- Коперниций в т. М.
- Нихоний в т. М.
- Флеровий в т. М.
- Московий в т. М.
- Ливерморий в т. М.
- Теннессин в т. М.
- Оганесон в т. М.
Часто задаваемые вопросы:
Положение элемента (номер в таблице) определяется его порядковым (атомным) номером (Z).
Который равен заряду ядра и числу электронов в нейтральном атоме.
Номер периода говорит о числе энергетических уровней (электронных слоев) в атоме.
Номер группы (для главных подгрупп) говорит о числе валентных электронов на внешнем уровне атома.
В периоде слева направо:
Атомный радиус → уменьшается.
Электроотрицательность и неметаллические свойства → усиливаются.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.