Теория:
Индий (In) в периодической системе: 5‑й период, 13‑я группа (по устаревшей классификации — III A), атомная масса 114,818 а.е.м.
Занимает положение в 5‑м периоде, что относит его к группе постпереходных металлов.
Индий известен своей исключительной мягкостью (его можно резать ножом) и способностью сохранять пластичность при сверхнизких температурах.
Будучи химическим аналогом галлия и таллия, он входит в состав p-блока элементов, обладая амфотерными свойствами и характерным металлическим блеском.
Нахождение Индия в 13‑й группе и наличие трех валентных электронов обуславливают его ключевые параметры:
Наиболее характерную валентность III.
А также критическую важность для современной электроники — индий является основой прозрачных проводящих покрытий (ITO) в экранах смартфонов и мониторов.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Kr] 4d10 5s2 5p1.
На которой наглядно можно определить его положение как p-блочного элемента, где начинается заполнение 5p-подуровня.
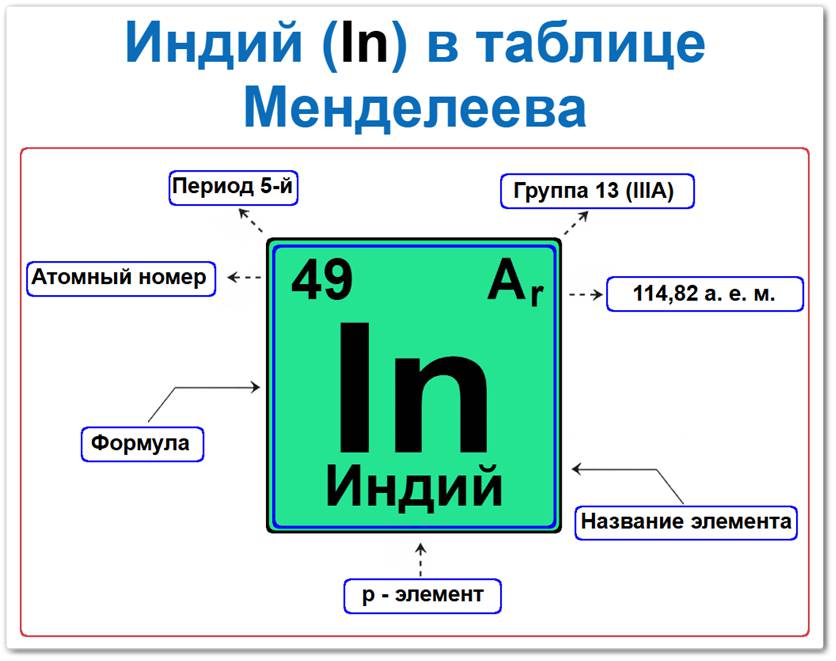
Индий в таблице Менделеева можно определить на основании закона периодичности: положение в главной подгруппе III группы, период 5, а также по его порядковому номеру (Z = 49).
Как определить положение Индия в Таблице Менделеева
Локация индия в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (13-я группа, подгруппа бора).
- Период (горизонтальный ряд 5).
- Электронное семейство (индий — p‑элемент).
Порядковый номер / атомный номер (Z = 49)
- Служит уникальным кодом элемента в системе.
- В ядре — 49 протонов; в нейтральной оболочке — 49 электронов.
- Электронное строение: [Kr] 4d10 5s2 5p1.
Важно: Особенность индия в том, что при его сгибании слышен характерный «крик» (хруст), вызванный разрушением кристаллической решетки — свойство, присущее также олову.
Название и символ
- Название: «индий» (от ярко-синей, цвета индиго, линии в спектре).
- Символ: In.
- Примечание: Открыт Фердинандом Райхом и Иеронимом Рихтером в 1863 году спектроскопическим методом в цинковых рудах.
Группа (13 / III A)
Расположен в 13‑й группе (подгруппа бора). В таблице Менделеева индий находится под галлием и над таллием.
Химический потенциал:
- Валентность индия: типичная валентность III, реже I.
- Степень окисления: +3 (основная), +1. Гидроксид индия проявляет слабые амфотерные свойства.
Период (5‑й)
Находится в 5‑м периоде — его электроны распределены по пяти энергетическим уровням.
Влияние на свойства:
- Физические свойства: Индий — один из самых мягких металлов, он сохраняет свою пластичность даже при температурах, близких к абсолютному нулю.
- Техническое применение: Используется для создания легкоплавких сплавов и в полупроводниковой технике (арсенид индия).
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(In) ≈ 114,818 а.е.м.
- Определение: среднее значение массы природных изотопов, основным из которых является стабильный Индий-115.
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Застраивающимся является 5p‑подуровнь (5p1).
Специфика блока: Как p-элемент, индий проявляет типичные свойства металлов главных подгрупп, занимая промежуточное положение между алюминием и более тяжелым таллием.
Определение энергетических уровней Индия по Таблице Менделеева
Положение Индия (In) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 5-й период (Количество этажей)
Номер периода определяет число электронных слоев.
- Итог: У Индия 5 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Индия — 49. Его 49 электронов распределены по уровням следующим образом:
In ) 2 ) 8 ) 18 ) 18 ) 3
Проверка знаний: Как определить индий по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Индий (In) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 49. Местоположение в системе по заряду ядра.
- 2) 5-й период, p-элемент. Характеристика по заполнению оболочек.
- 3) Постпереходный металл. Индий находится в группе металлов после d-блока.
- 4) Ошибка. Галогены — это подгруппа фтора.
- 5) Ошибка. Индий — тяжелый металл 5-го периода.
- 6) Ошибка. Масса индия составляет 114,818 а.е.м.
Часто задаваемые вопросы:
Индий расположен в 5-м периоде. Относится к 13-й группе (главной подгруппе III группы). Его порядковый номер — 49.
У индия 5 энергетических уровней.
Электронная схема распределения: 2, 8, 18, 18, 3.
Индий является p-элементом. Его химические свойства определяются наличием одного электрона на 5p-подуровне.