Теория:
Нобелий (No) располагается в нижнем ряду 7‑го периода, входя в семейство актиноидов, что во многом объясняет его нестабильную и радиоактивную сущность.
Являясь аналогом иттербия (Yb) среди лантаноидов, этот трансурановый элемент проявляет уникальное химическое поведение: в отличие от большинства актиноидов, для него наиболее характерна степень окисления +2 в водных растворах.
Его принадлежность к f‑блоку (семейство актиноидов) предопределяет основные характеристики:
- Доминирующую валентность II и теоретически возможную III.
- Степень окисления числа +2 и +3.
Строение атома подтверждается его электронной формулой:
[Rn] 5f14 7s2.
Благодаря полностью заполненной 5f‑оболочке, нобелий можно считать завершающим звеном в ряду тяжёлых металлов, чьи свойства плавно переходят к лоуренсию.
Нобелий (No) — это f‑элемент группы актиноидов, находящийся в 7‑м периоде.
Данная локация в таблице Менделеева (системе химических элементов) диктует, каков будет характер взаимодействия атома и его реакционная способность в условиях лабораторного анализа.
Как определить положение Нобелия в Таблице Менделеева
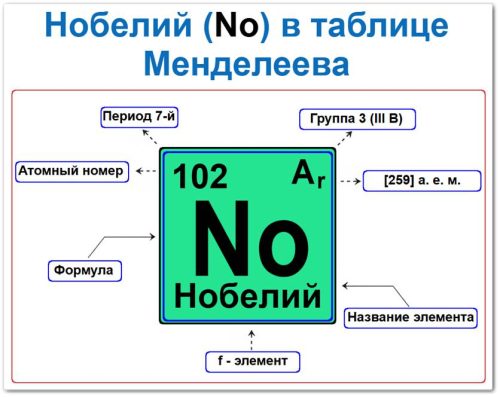
Местоположение нобелия в структуре таблицы описывается параметрами его тяжёлого искусственного ядра — его индивидуальной «карточкой»:
- Порядковый номер (атомное число).
- Наименование и обозначение.
- Семейство (актиноиды).
- Период (горизонтальный цикл).
- Электронное семейство (нобелий — f‑элемент).
Порядковый номер / атомный номер (Z = 102)
- Служит уникальным маркером в шеренге трансурановых элементов.
- Ядро содержит 102 протона; вокруг него в нейтральном состоянии вращаются 102 электрона.
- Конфигурация электронных оболочек: [Rn] 5f14 7s2.
Важно: полностью укомплектованный 5f-подуровень (5f14) придает элементу особую устойчивость в степени окисления +2, что выделяет его на фоне соседей.
Название и символ
- Название: «нобелий» (в честь Альфреда Нобеля, учредителя Нобелевской премии).
- Символ (знак): No.
Примечание: право на открытие элемента долгое время оспаривалось между группами учёных из Швеции, США и СССР, что отражает сложность работы с ультракороткими временами жизни ядер.
Семейство (Актиноиды)
Входит в состав 14 элементов, следующих за актинием, которые выносятся в отдельный ряд под основной частью таблицы.
Что это дает элементу:
- Наличие электронов на глубоком 5f-подуровне.
- Валентность нобелия: наиболее стабильна II, хотя для большинства актиноидов типична III.
- Степени окисления: +2 (доминирующая) и +3.
Важно: нобелий — первый из актиноидов, у которого состояние +2 является более выгодным, чем +3, из-за стабильности заполненной оболочки f14.
Период (7‑й)
Принадлежит к завершающему 7‑му периоду — электроны распределены по семи энергетическим слоям.
Что дает элементу:
- Значительные размеры атомного радиуса и сильное влияние внутренних слоев на внешние электроны.
- Закономерность: находясь в конце ряда актиноидов, нобелий демонстрирует уменьшение радиуса иона (актиноидное сжатие), что влияет на его химическое сродство.
Относительная атомная масса (Ar)
- Ar(No) ≈ [259] а.е.м. (для наиболее стабильного нуклида).
- Значение: суммарное количество нуклонов в ядре, синтезированном в ускорителе.
- Радиоактивность: все изотопы нобелия крайне недолговечны; изотоп 259No имеет период полураспада всего около 58 минут.
Все значения для всех элементов можно узнать в таблице атомных масс.
f‑Элемент (Электронное облако)
Дифференцирующий электрон достраивает внутренний f‑подуровень (5f14).
Что дает элементу:
- Специфические спектральные линии и парамагнитные свойства ионов.
Определение энергетических уровней Нобелия по Таблице Менделеева
Положение Нобелия (No) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
Являясь одним из последних представителей семейства актиноидов, он демонстрирует завершение заполнения глубоких электронных оболочек перед переходом к сверхтяжелым металлам.
1. 7-й период (Количество этажей)
Нобелий находится в седьмой строке таблицы. По фундаментальному закону химии: номер периода всегда равен количеству электронных слоев.
Итог: у Нобелия 7 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Нобелия — 102. Его 102 электрона распределены по уровням следующим образом:
No ) 2 ) 8 ) 18 ) 32 ) 32 ) 8 ) 2
Для сравнения: у соседа слева, Менделеевия (101), на 5-м уровне (f-подуровень) находится 13 электронов, а у Нобелия (102) этот уровень полностью завершается 14-м электроном (конфигурация 5f14). Это делает его атом крайне стабильным с точки зрения электронной симметрии.
3. 3-я группа (Химический характер)
Формально Нобелий относится к 3-й группе (подгруппа Скандия), так как является частью семейства актиноидов.
- f‑элемент: его химическая природа определяется заполненной 5f‑оболочкой. В отличие от d-элементов, его валентные электроны спрятаны глубоко внутри.
- Место в блоке: Нобелий является тяжелым аналогом Иттербия. В химических реакциях он проявляет необычную для актиноидов стабильность в степени окисления +2, что объясняется полностью заполненным f-подуровнем.
Проверка знаний: Как определить Нобелий по таблице Менделеева
Выберите три верных тезиса, которые точно описывают Нобелий (No).
По каким маркерам можно безошибочно опознать элемент №102?
Показать правильные ответы и разбор
Верные ответы: 1, 2, 3
- 1) В ядре 102 протона. Это атомный номер, определяющий место No в системе.
- 2) Семейство актиноидов, 7-й период. Локация элемента в нижних рядах таблицы.
- 3) Конфигурация 5f14 7s2. Отражает полную заполненность f-слоя, что объясняет стабильность степени окисления +2.
- 4) Использование в быту. Ошибка: элемент крайне радиоактивен и существует лишь в лабораториях.
- 5) Месторождения в природе. Ошибка: нобелий — искусственный трансурановый элемент.
- 6) Стабильность. Ошибка: это радиоактивный металл с коротким временем жизни.
Часто задаваемые вопросы:
Атомный номер: 102;
Период: 7;
Группа: актиниды (f‑блок).
Искусственный, высокорадиоактивный элемент;
Наиболее стабильная степень окисления: +2 (реже +3);
Самый стабильный изотоп: ²⁵⁹No (период полураспада ~58 минут);
Предполагаемое агрегатное состояние: твёрдый металл (серебристо‑белый/серый).
Исключительно научные исследования (изучение сверхтяжёлых элементов).