Теория:
Лоуренсий (Lr) замыкает ряд актиноидов в 7‑м периоде, что определяет его уникальную и сложную природу.
В периодической системе элементов (таблице Менделеева) он занимает место на стыке f- и d-блоков.
Будучи тяжёлым аналогом лютеция, из‑за влияния квантовых эффектов он проявляет свойства, характерные для активных металлов, оставаясь при этом короткоживущим трансурановым объектом.
А его принадлежность к 3‑й группе (или по классической версии III B) задаёт его ключевые параметры:
- Наиболее стабильную валентность III.
- Единственную степень окисления +3.
Которые подтверждаются его электронной структурой (конфигурацией):
[Rn] 5f14 7s2 7p1.
На которой отчётливо можно увидеть его положение как финального звена в семействе «тяжёлых близнецов» — актиноидов.
Лоуренсий (Lr) — это p‑элемент (согласно современным расчётам оболочки 7p) или формальный d-элемент 3‑й группы 7‑го периода.
Данные координаты в системе химических элементов определяют, какой будет реакционная способность и валентность металла в экспериментах по атомному синтезу.
Как определить положение Лоуренсия в Периодической таблице
Местоположение лоуренсия в реестре задаётся параметрами радиоактивного нестабильного ядра — его индивидуальным «химическим паспортом»:
- Порядковый номер (регистрационный номер в таблице).
- Наименование (название) элемента.
- Группа (вертикальный ряд).
- Период (горизонтальная строка).
- Электронное семейство (блок).
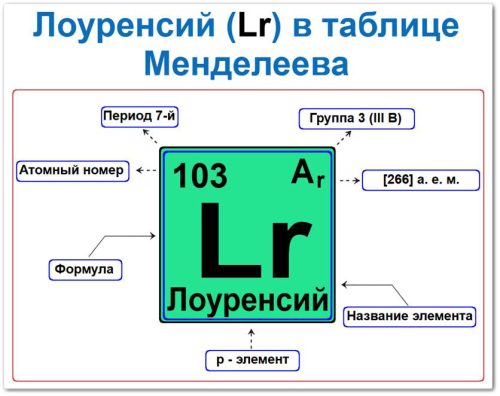
Порядковый номер / атомный номер (Z = 103)
- Точно идентифицирует элемент в списке трансурановых нуклидов.
- В ядре — 103 протона; в нейтральном атоме — 103 электрона.
- Электронная формула: [Rn] 5f14 7s2 7p1.
Важно: наличие одного электрона на 7p-подуровне — это уникальная черта лоуренсия, которая отличает его от «классических» актиноидов и делает похожим по строению на элементы 3-й группы.
Название и символ
- Название: «лоуренсий» (в честь создателя циклотрона Эрнеста Лоуренса).
- Символ: Lr.
Примечание: элемент был предметом спора между Дубной (СССР) и Беркли (США), что типично для истории открытия тяжелых ядер.
Группа (3 / III B)
Расположен в 3‑й группе; в старой номенклатуре — побочная подгруппа III группы (подгруппа скандия).
Что дает элементу:
- 3 валентных электрона.
- Валентность: единственная и стабильная — III.
- Степень окисления: в растворах и соединениях всегда проявляет +3.
Важно: лоуренсий ведет себя как типичный трёхвалентный металл, очень похожий по поведению на лантаноиды, что облегчает его выделение методами хроматографии.
Период (7‑й)
Находится в финальном 7‑м ряду — электроны распределены по семи энергетическим уровням.
Что дает элементу:
- Огромный размер атома и сильное экранирование положительного заряда ядра внутренними слоями.
- Релятивистские поправки: благодаря высокой скорости электронов у тяжелого ядра, 7p-орбиталь опускается ниже, чем ожидалось. Это делает лоуренсий первым элементом в 7-м периоде, начинающим заполнение p-блока.
Относительная атомная масса (Ar)
- Ar(Lr) ≈ [266] а.е.м. (для самого долгоживущего изотопа 266Lr).
- Значение: суммарная масса нуклонов, зафиксированная при синтезе.
- Уникальность: изотопы лоуренсия крайне нестабильны. Самый «живучий» из них имеет период полураспада около 11 часов, что по меркам сверхтяжелых элементов — целая вечность.
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (Электронное семейство)
Согласно современным данным IUPAC, последний электрон занимает 7p-подуровень.
Что дает элементу:
- Это делает его «формальным» p-элементом, хотя по химическим повадкам он остается близнецом d-элементов (как лютеций).
Определение энергетических уровней Лоуренсия по Таблице Менделеева
Положение Лоуренсия (Lr) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
Завершая ряд актиноидов, он является пограничным элементом, который отделяет f-семейство от тяжелых переходных металлов 7-го периода.
1. 7-й период (Количество этажей)
Лоуренсий находится в седьмой строке таблицы. По фундаментальному закону химии: номер периода всегда равен количеству электронных слоев.
Итог: у Лоуренсия 7 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Лоуренсия — 103. Его 103 электрона распределены по уровням следующим образом:
Lr )2 )8 )18 )32 )32 )9 )2
Для сравнения: у соседа слева, Нобелия (102), на предпоследнем уровне 8 электронов (в рамках f-заполнения), а у Лоуренсия (103) появляется 9-й электрон на переходном уровне. Это знаменует полное завершение заполнения 5f-оболочки.
3. 3-я группа (Химический характер)
Лоуренсий замыкает 3-ю группу (в составе семейства актиноидов), располагаясь формально под Скандием, Иттрием и Лютецием.
- f‑элемент (финальный): его химическая природа определяется полностью заполненной 5f-оболочкой, что делает его химически похожим на тяжелые лантаноиды.
- Место в блоке: он является «тяжелым аналогом» лютеция. Как последний из актиноидов, Лоуренсий проявляет стабильную степень окисления +3, что характерно для элементов начала побочных подгрупп.
Проверка знаний: Как определить Лоуренсий по таблице Менделеева
Выберите три верных признака, которые безошибочно указывают на Лоуренсий (Lr).
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Порядковый номер 103. Это уникальное «имя» лоуренсия в мире атомов.
- 2) 3-я группа, 7-й период. Точные координаты в таблице Менделеева.
- 3) Завершает актиноиды. Лоуренсий — 15-й и последний элемент ряда актиноидов.
- 4, 5, 6 — Ошибки. Лоуренсий радиоактивен, в природе не встречается и не имеет ничего общего с газами или бытовыми металлами.
Часто задаваемые вопросы:
Он расположен в 7-м периоде и формально относится к 3-й группе. Его атомный номер — 103.
Относительная атомная масса Лоуренсия — [266] а.е.м. Скобки означают, что элемент не имеет стабильных изотопов и получен искусственно.
Число 266 — это масса самого долгоживущего изотопа, время жизни которого составляет всего около 11 часов.
Несмотря на радиоактивность, ученые доказали, что он ведет себя как типичный элемент 3-й группы. Его самая стабильная степень окисления — +3.