Теория:
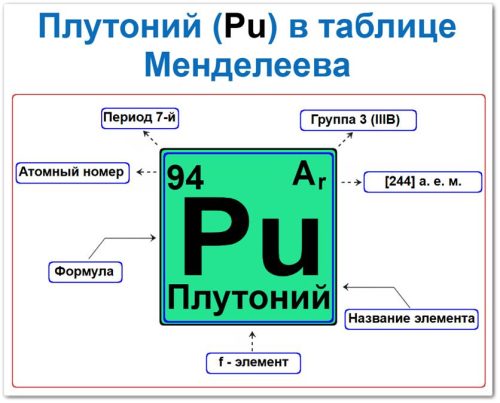
Плутоний (Pu) в периодической системе: 7‑й период, 3‑я группа (по устаревшей классификации — IIIB), атомная масса [244] (массовое число наиболее устойчивого изотопа).
Это определяет его принадлежность к группе актиноидов — тяжелых трансурановых элементов, открывающих эру атомной энергетики.
Будучи химическим гомологом (аналогом) лантаноида самария, он проявляет свойства серебристо-белого радиоактивного металла.
Его уникальность заключается в том, что плутоний имеет пять-шесть аллотропных модификаций, а его поведение продиктовано заполнением 5f-подуровня.
А его нахождение в 3‑й группе (семейство актиноидов) задает его базовые параметры, при этом плутоний демонстрирует рекордное разнообразие степеней окисления (от +3 до +7), что делает его химию одной из самых сложных в таблице Менделеева.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Rn] 5f6 7s2.
На которой наглядно можно определить его положение как f-элемента, находящегося между нептунием и америцием.
Плутоний в таблице Менделеева можно определить на основании закона периодичности: положение в группе и периоде, а также порядкового номера / атомный номер (Z = 94)
Как определить положение Плутония в Таблице Менделеева
Локация плутония в таблице описывается характеристиками его радиоактивного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд актиноидов).
- Период (горизонтальный ряд).
- Электронное семейство (плутоний — f‑элемент).
Порядковый номер / атомный номер (Z = 94)
- Служит уникальным кодом элемента в ряду трансурановых металлов.
- В ядре — 94 протона; в нейтральной оболочке — 94 электрона.
- Электронное строение: [Rn] 5f6 7s2.
Важно: Плутоний — это первый элемент в таблице, который был произведен в промышленных масштабах человеком, несмотря на его исчезающе малые следы в природной урановой руде.
Название и символ
- Название: «плутоний» (в честь планеты Плутон, продолжая традицию за Ураном и Нептунием).
- Символ: Pu.
- Примечание: Элемент был синтезирован в 1940 году группой Гленна Сиборга путем бомбардировки урана дейтерием.
Группа (3 / III B)
Расположен в 3‑й группе (в ряду актиноидов), объединяющей элементы f-блока с переменной валентностью.
Химический потенциал:
- Валентность плутония: проявляет переменную валентность от III до VII.
- Степень окисления: наиболее устойчива в растворах +4, но плутоний уникален тем, что в одном растворе могут одновременно сосуществовать четыре его состояния окисления (+3, +4, +5, +6).
Период (7‑й)
Находится в 7‑м периоде — его электроны распределены по семи энергетическим уровням.
Влияние на свойства:
- Актиноидное сжатие: Определяет плотную упаковку атомов в кристаллической решетке.
- Пирофорность: Из-за высокой реакционной способности мелкодисперсный плутоний может самовоспламеняться на воздухе при комнатной температуре.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Pu) ≈ [244] а.е.м. (для самого долгоживущего изотопа 244Pu).
- Определение: средняя масса наиболее стабильного нуклида.
- Значимость: Изотоп Pu-239 является ключевым делящимся материалом для ядерного оружия и некоторых типов атомных реакторов.
Все значения для всех элементов можно узнать в таблице атомных масс.
f‑Элемент (электронное семейство)
Застраивающимся является 5f‑подуровень (5f6).
Специфика блока: Электроны 5f-оболочки плутония находятся на границе между локализованным и делокализованным состоянием, что объясняет резкие скачки объема металла при изменении температуры.
Определение энергетических уровней Плутония по Таблице Менделеева
Положение Плутония (Pu) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 7-й период (Количество этажей)
Плутоний находится в седьмой строке таблицы. Номер периода определяет число слоев.
- Итог: У Плутония 7 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Плутония — 94. Его 94 электрона распределены по уровням следующим образом:
Pu ) 2 ) 8 ) 18 ) 32 ) 24 ) 8 ) 2
Для сравнения: У соседа слева, Нептуния (93), на пятом уровне 23 электрона, а у Плутония (94) — 24.
3. 3-я группа (Химический характер)
Плутоний — активный участник семейства актиноидов.
- f-элемент: Его свойства зависят от состояния 5f-электронов.
- Место в блоке: Он является тяжелым аналогом самария (Sm). Как и самарий, плутоний имеет сложную кристаллическую структуру и высокую магнитную восприимчивость.
Проверка знаний: Как определить плутоний по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Плутоний (Pu) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 94. Это фундаментальное положение плутония в системе.
- 2) Актиноид 7-го периода. Точное место в f-блоке под лантаноидами.
- 3) Аналог самария. Сходство конфигураций f-оболочек делает их химическими родственниками.
- 4) Ошибка. Плутоний чрезвычайно токсичен и радиоактивен, его оборот строго контролируется.
- 5) Ошибка. Плутоний — активный металл, а не газ.
- 6) Ошибка. Плутоний был открыт только в середине XX века (1940 г.).
Часто задаваемые вопросы:
Расположен в 7-м периоде, 3-й группе (актиноиды). Его атомный номер — 94.
Плутоний имеет 7 энергетических уровней. Распределение электронов по слоям: 2, 8, 18, 32, 24, 8, 2.
Потому что у него последними заполняются электронами внутренние орбитали 5f-подуровня, что характерно для семейства актиноидов.