Теория:
Электроотрицательность — это фундаментальное свойство атома, которое описывает его способность притягивать к себе общие электронные пары в химических связях с другими атомами.
Это ключевой показатель, который определяет полярность связи и тип химической связи (ионная или ковалентная).
Проще говоря, электроотрицательность показывает, кто «сильнее» в химическом «перетягивании каната» за общие электроны.
Атом с высокой электроотрицательностью (например, фтор, кислород) всегда будет тянуть электроны к себе, становясь частично отрицательным (δ⁻).
А атом с низкой электроотрицательностью (например, натрий, цезий) — отдавать их, становясь частично положительным (δ⁺).
Эта разница в силе и определяет, будет ли связь прочным «канатом» (ковалентная связь) или произойдёт полный «захват» (ионная связь).
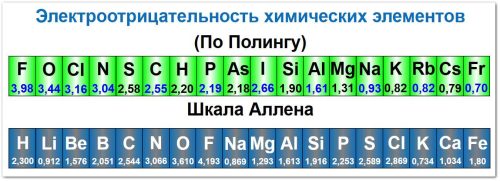
Основные принципы и шкала Л. Полинга
Шкала Полинга (наиболее распространённая): Электроотрицательность обычно измеряется по шкале, предложенной американским химиком Лайнусом Полингом.
Значения электроотрицательности лежат в диапазоне примерно от 0,7 до 4,0.
Самый электроотрицательный элемент: Фтор (F) с ЭО = 4,0.
Самые электроположительные элементы: Франций (Fr) и Цезий (Cs) с ЭО ≈ 0,7.
Шкала Аллена вместо Полинга
В 2013 году IUPAC рекомендовал использовать шкалу Аллена для сравнения электроотрицательностей при расчёте степеней окисления, так как шкала Полинга имеет некоторые неточности.
Например, по шкале Аллена электроотрицательность азота (3,066) выше, чем хлора (2,869), что согласуется с данными о гидролизе NCl3.
Как электроотрицательность влияет на связь
Разница в электроотрицательности (ΔЭО) между двумя связанными атомами определяет характер связи:
| Разница в ЭО (ΔЭО | Тип связи | Смещение электронов | Пример |
|---|---|---|---|
| ΔЭО ≈ 0 | Неполярная ковалентная | Электроны распределены равномерно | H–H |
| 0,4 < ΔЭО < 1,7 | Полярная ковалентная | Электроны смещены к более ЭО атому | H–Cl |
| ΔЭО ≥ 1,7 | Ионная | Почти полный переход электрона | Na+–Cl— |
Влияние на степень окисления
Степень окисления — это условный заряд атома в соединении, рассчитанный из предположения, что все связи ионные, то есть электроны полностью переходят к более электроотрицательному атому.
- Атом с большей электроотрицательностью притягивает электроны и получает отрицательную степень окисления.
- Атом с меньшей электроотрицательностью отдаёт электроны и получает положительную степень окисления.
Влияние электроотрицательности на валентность
Электроотрицательность (ЭО) и валентность (В) — это два фундаментальных, но различных понятия в химии.
Валентность — это структурное свойство атома, которое определяет количество химических связей, которые он может образовать.
Она напрямую связана с числом неспаренных электронов на внешнем энергетическом уровне атома.
Например, углерод (C) всегда стремится быть четырехвалентным, а кислород (O) — двухвалентным, исходя из их потенциального числа валентных электронов.
ЭО напрямую не изменяет это потенциальное число связей.
Закономерности в Периодической системе
Электроотрицательность не является постоянной величиной и закономерно меняется по Периодической системе:
По периоду (слева направо): электроотрицательность увеличивается.
Причина: заряд ядра растёт, радиус атома уменьшается, ядро сильнее притягивает внешние электроны.
По группе (сверху вниз): электроотрицательность уменьшается.
Причина: увеличивается число электронных слоёв, внешний слой дальше от ядра (эффект экранирования), притяжение ослабевает.
Таким образом: наиболее электроотрицательные элементы находятся в правом верхнем углу таблицы (галогены, кислород),
наименее электроотрицательные — в левом нижнем углу (щелочные и щелочноземельные металлы).
Часто задаваемые вопросы:
Это способность атома притягивать к себе валентные электроны в химической связи.
Чем выше ЭО, тем сильнее атом «оттягивает» электроны от партнёра по связи.
В периоде (слева → вправо) — растёт: увеличивается заряд ядра, уменьшается радиус атома.
В группе (сверху → вниз) — уменьшается: растёт число электронных слоёв, усиливается экранирование ядра.
Самые высокие значения — у F (≈ 4,0), O, N, галогенов (правый верхний угол).
Самые низкие — у Fr, Cs, щелочных металлов (левый нижний угол).
Тип связи: ΔЭО ≈ 0 → неполярная ковалентная (H–H);
0,4 < ΔЭО < 1,7 → полярная ковалентная (H–Cl);
ΔЭО ≥ 1,7 → ионная (Na⁺Cl⁻).
Распределение зарядов: атом с большей ЭО получает отрицательный эффективный заряд.
Степень окисления: более электроотрицательный атом обычно имеет отрицательную степень окисления.
Валентность: высокая ЭО ограничивает возможность возбуждения атома и расширения валентности (например, у F всегда валентность I).