Теория:
Углерод (C) — типичный неметалл и основа органической химии. Его химическое поведение определяется положением в Периодической таблице.
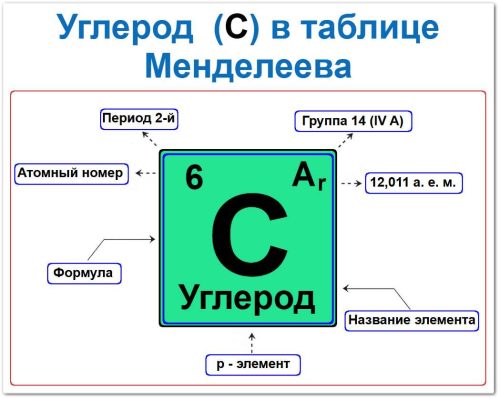
Идентификация углерода: атомный номер Z = 6, электронная конфигурация: 1s2 2s2 2p2.
Местоположение: 2‑й период, 14‑я группа (IV A).
Это объясняет:
-
Наличие четырёх валентных электронов;
-
Способность образовывать четыре ковалентные связи;
-
Диапазон степеней окисления углерода от –4 до +4.
Важные следствия
-
Валентность: почти всегда четырёхвалентен (IV) благодаря переходу в возбуждённое состояние (2s1 2p3).
-
Основа жизни: отсутствие d‑орбиталей и принадлежность к 14‑й группе обеспечивают прочность и стабильность ковалентных связей, а также способность к образованию длинных цепей.
Как определить положение углерода в Таблице Менделеева
Положение углерода в таблице задаётся несколькими фундаментальными характеристиками — своего рода «химическим паспортом»:
- Порядковый номер и атомный номер.
- Название элемента.
- Группа (вертикальный столбец).
- Период (горизонтальный ряд).
- Электронный блок, (p‑элемент).
Порядковый номер / Атомный номер (Z = 6)
-
В ядре атома содержится 6 протонов.
-
В нейтральном атоме — 6 электронов.
-
Электронная конфигурация: 1s2 2s2 2p2.
-
Основные изотопы: 12C, 13C (стабильные) и 14C (радиоактивный, используется для датирования).
Название элемента («Углерод»)
-
Лингвистический идентификатор для элемента с Z = 6.
-
Символ: C (от лат. Carboneum).
-
Название отражает историческую роль как компонента угля.
-
Химические особенности: способность образовывать аллотропы (графит, алмаз, фуллерены, графен).
Группа (14‑я / IV A)
-
Углерод имеет 4 валентных электрона (2s2 2p2).
-
Диапазон степеней окисления:
-
Максимальная: +4 (например, CO2, CCl4).
-
Минимальная: –4 (например, CH4, SiC).
-
Возможные промежуточные: +2 (CO), 0 (в простых веществах).
-
-
Центральная позиция в системе: может быть как восстановителем (+4), так и окислителем (–4).
Период (2‑й / горизонтальный ряд)
-
Углерод имеет две энергетические оболочки (K, L).
-
Отсутствие d‑орбиталей ограничивает валентность углерода IV и обеспечивает прочность связей.
-
Малый размер атома позволяет образовывать прочные цепи и кольца.
-
Радиус атома ≈ 77 пм, что способствует образованию двойных и тройных связей (C = C, C ≡ C).
Относительная атомная масса Углерода (Ar(C) ≈ 12,011 а.е.м.)
Роль в идентификации Атомная масса (Ar) — это средневзвешенное значение массы природных изотопов элемента, выраженное в атомных единицах массы.
Для Углерода она равна примерно 12,011 а.е.м., что традиционно округляется до 12.
Влияние на положение в таблице
-
Историческая роль: до открытия протона и атомного номера (Z) элементы располагались в таблице Менделеева по возрастанию атомных масс.
-
Современная роль: сегодня атомная масса используется для:
-
расчётов в химии (например, при определении молярной массы);
-
подтверждения положения элемента: для Углерода (Z = 6) она приблизительно равна сумме числа протонов и нейтронов в наиболее распространённом изотопе (¹²C), что составляет 6 + 6 = 12.
-
Все значения для всех элементов можно узнать в таблице атомных масс.
Важно: почему Ar не является главным идентификатором
Существуют изотопы: атомная масса является дробным числом (12,011), которое зависит от распространённости изотопов. Основным является ¹²C, но изотоп ¹³C немного увеличивает среднее значение.
Нарушения порядка: в Периодической таблице, построенной строго по атомным массам, возникали бы нарушения химического сходства. Атомный номер (Z) устраняет эти нарушения и является фундаментальным идентификатором.
p‑Элемент (электронное семейство)
-
Последний электрон находится на p‑подуровне (2p2).
-
Средняя электроотрицательность (≈ 2,55 по Полингу) позволяет образовывать связи как с металлами, так и с неметаллами.
-
Основное свойство: способность к гибридизации (sp3, sp2, sp) и образованию связей разной кратности.
-
Уникальная способность к образованию аллотропов.
Проверка знаний: Как определить углерод по таблице Менделеева
Отметьте три правильных утверждения, которые однозначно определяют Углерод (C) в Периодической системе.
По каким признакам можно безошибочно установить, что речь идёт именно об Углероде?
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) В атомном ядре содержится ровно 6 протонов.
Это главный отличительный признак: число протонов (Z=6) однозначно задаёт химический элемент. - 2) Находится во втором периоде и 14-й группе (IV A).
Это уникальное сочетание положения в таблице, которое определяет: две электронные оболочки и четыре валентных электрона. - 3) Полный набор электронов: $\mathbf{1s2 2s2 2p2.
Общее число электронов (6) совпадает с Z, а конфигурация внешней оболочки (2s2 2p2) определяет его химию и способность к тетравалентности. - 4) Может проявлять исключительно степень окисления +4.
Неверно: Углерод проявляет широкий диапазон СО, включая -4 (в метане CH4) и +2 (в угарном газе CO). - 5) Обладает тремя электронными оболочками.
Неверно: Углерод находится во 2-м периоде и имеет только две оболочки. - 6) Является первым элементом в своей группе, который образует p-элементный блок.
Неверно: p-элементы начинаются с 13-й группы (B).
Часто задаваемые вопросы:
Z = 6. Это 6 протонов в ядре.
Во 2-м периоде и 14-й группе (IV A).
Тетравалентность (IV) и способность к катенации (образованию стабильных атомных цепей).

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.