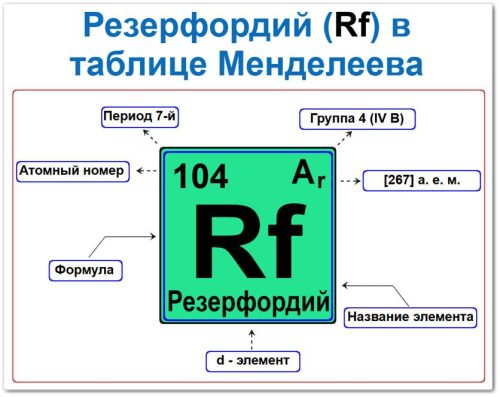
Теория:
Резерфордий (Rf) занимает ключевое положение в 7‑м периоде, что обуславливает его уникальную физико-химическую природу.
Являясь первым трансактиноидом и аналогом гафния, в периодической системе элементов он открывает ряд сверхтяжёлых d‑элементов.
Из‑за значительных релятивистских эффектов его электронные оболочки ведут себя специфично, однако он сохраняет статус типичного переходного металла.
Его принадлежность к 4‑й группе (по классификации ИЮПАК) или IV B группе по старой версии таблицы Менделеева определяет его базовые характеристики: наиболее стабильную валентность IV и доминирующую степень окисления +4.
Эти свойства диктуются его электронной конфигурацией:
[Rn] 5f14 6d2 7s2.
На основе этой формулы можно безошибочно идентифицировать его как первого представителя семейства d‑блока в нижней части системы химических элементов.
Резерфордий (Rf) — это d‑элемент 4‑й группы 7‑го периода.
Данная локация в структуре периодического закона предопределяет реакционную способность и координационные числа элемента в условиях сложнейших экспериментов по ядерному синтезу.
Как определить положение Резерфордия в Таблице Менделеева
Местоположение резерфордия в графическом отображении периодического закона фиксируется набором параметров его «химического паспорта»:
- Атомный (порядковый) номер.
- Наименование и символ.
- Группа (вертикальный ряд).
- Период (горизонтальный уровень).
- Электронное семейство (резерфордий d — элемент).
Порядковый номер / атомный номер (Z = 104)
- Служит уникальным идентификатором в ряду искусственно синтезированных тяжеловесов.
- В ядре сосредоточено 104 протона; электронное облако нейтрального атома содержит 104 электрона.
- Полная электронная формула: [Rn] 5f14 6d2 7s2.
Важно: Наличие вакантных и заполняемых d‑орбиталей роднит его с титаном, цирконием и гафнием, но экстремальный заряд ядра вносит поправки в энергию связи электронов.
Название и символ
- Название: «резерфордий» (в честь великого физика Эрнеста Резерфорда).
- Символ: Rf.
Примечание: Утверждение этого имени в реестре элементов положило конец многолетним спорам между советскими («курчатовий») и американскими учёными.
Группа (4 / IV B)
Находится в 4‑й группе; согласно традиционной классификации — побочная подгруппа IV группы (подгруппа титана).
Что это дает элементу:
- 4 валентных электрона на внешних уровнях (6d2 7s2).
- Валентность резерфордия: IV является наиболее устойчивой и экспериментально подтверждённой.
- Степень окисления: положение в таблице элементов задаёт диапазон до +4.
- Типичные степени окисления: +4 (доминирующая). В отличие от более лёгких аналогов, низшие степени окисления менее характерны.
Важно: Резерфордий образует летучие хлориды и бромиды (например, RfCl4), что роднит его с гафнием и доказывает его принадлежность к этой группе.
Период (7‑й)
Завершает вертикаль подгруппы титана в последнем незавершённом ряду системы Менделеева.
Влияние периода:
- Наличие семи энергетических уровней.
- Релятивистское сжатие: 7s-орбитали сжимаются и стабилизируются, что влияет на ионный радиус.
- Химическое сходство: Несмотря на тяжесть, Rf демонстрирует свойства типичного металла группы 4, а не актиноида.
Относительная атомная масса (Ar)
- Ar(Rf) ≈ [267] а.е.м. (для наиболее стабильного изотопа 267Rf).
- Отражает массу самого устойчивого нуклида, полученного в ускорителях.
Радиоактивность: Период полураспада исчисляется минутами или секундами, что делает невозможным накопление макроскопических количеств.
Все значения для всех элементов можно узнать в таблице атомных масс.
d‑Элемент (электронное семейство)
Дифференцирующий электрон попадает на d‑подуровнь (6d2).
Это классифицирует его как переходный металл в общей системе элементов.
Его химическое поведение определяется участием d‑электронов в образовании химических связей.
Определение энергетических уровней Резерфордия по Таблице Менделеева
Положение Резерфордия (Rf) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
Являясь первым элементом после ряда актиноидов, он открывает путь к сверхтяжелым d-металлам и служит фундаментом для понимания структуры своих соседей — Дубния и Сиборгия.
1. 7-й период (Количество этажей)
Резерфордий находится в седьмой строке таблицы. По фундаментальному закону химии: номер периода всегда равен количеству электронных слоев.
Итог: у Резерфордия 7 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Резерфордия — 104. Его 104 электронов распределены по уровням следующим образом:
Rf )2 )8 )18 )32 )32 )10 )2
Для сравнения: у соседа слева, Лоуренсия (103), на предпоследнем уровне 9 электронов, а у Резерфордия (104) — 10. Именно этот «десятый» электрон на d-подуровне делает его первым полноправным переходным металлом в 7-м периоде.
3. 4-я группа (Химический характер)
Резерфордий стоит в одной колонке (группе) с Титаном, Цирконием и Гафнием.
- d‑элемент: его химическая природа определяется началом заполнения 6d‑подуровня, что выводит его из семейства f-элементов.
- Место в блоке: он является «тяжелым аналогом» гафния. Эксперименты подтвердили, что Резерфордий образует тетрахлориды (RfCl4), очень похожие по свойствам на хлориды циркония и гафния.
Проверка знаний: Как определить резерфордий по таблице Менделеева
Выберите три верных тезиса, описывающих положение Резерфордия (Rf) в Периодической таблице.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Порядковый номер 104. Это адрес элемента в таблице Менделеева.
- 2) 4-я группа и 7-й период. Это местоположение делает его аналогом циркония и гафния.
- 3) Конфигурация 6d27s2. Наличие электронов на d-подуровне подтверждает его статус переходного металла.
- 4, 5, 6 — ложные утверждения. Rf — радиоактивен, находится в группе с титаном (не углеродом) и является металлом.
Часто задаваемые вопросы:
Резерфордий (Rf) — высокорадиоактивный синтетический металл, первый из трансактиноидных элементов с номером 104.
В 4-й группе (подгруппа титана), в 7-м периоде. Относится к семейству d-металлов.
Сходен с гафнием (Hf). Проявляет стабильную степень окисления +4 и образует комплексные соединения, характерные для переходных металлов IV группы.