Галогены это химические вещества, каждый из них простое вещество, встречается в природе только в виде соединений.
Каждый из галогенов имеют свои уникальные свойства, например хлор в соединении с натрием образует хлорид натрия NaCl который есть неотъемлемая часть жизнедеятельности организма.

Что такое галогены
Химические элементов главной подгруппы седьмой группы (устаревшая таблица) и по новой в 17-й группе периодической таблицы химических элементов Д. И. Менделеева — которые являются типичными неметаллами, элементы фтор (Fluorum), хлор (Chlorum), бром (Bromum), иод (Jodum) и астат (Astatine) называются галогенами.
Это название, которое буквально означает «солерождающие», элементы получили за способность взаимодействовать с металлами с образованием типичных солей, например хлорида натрия NaCl.
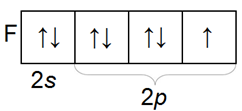
Во внешнем электронном слое атомы галогенов содержат семь электронов — два на s— и пять на р-орбиталях (ns2np5).
Галогены обладают значительным сродством к электрону — их атомы легко присоединяют электрон, образуя однозарядные отрицательные ионы, обладающие электронной структурой соответствующего благородного газа (ns2np6).
Аналогичное строение наружного электронного слоя обусловливает большое сходство галогенов друг с другом, проявляющееся как в их химических свойствах, так и в типах и свойствах образуемых ими соединений.
Но, как показывает сопоставление свойств галогенов, между ними имеются и существенные различия.
С повышением порядкового номера элементов в ряду F — At увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства и окислительная способность элементов.
Склонность к присоединению электронов характеризует галогены как типичные неметаллы.
В отличие от других галогенов, фтор в своих соединениях всегда находится в степени окисленности —1, поскольку среди всех элементов он обладает самой высокой электроотрицательностью.
Остальные галогены проявляют различные степени окисленности от —1 до +7.
За исключением некоторых оксидов, которые будут рассмотрены ниже, все соединения галогенов соответствуют нечетным степеням окисленности.
Такая закономерность обусловлена возможностью последовательного возбуждения спаренных электронов в атомах Cl, Вr, I и At на d-подуровень, что приводит к увеличению числа электронов, принимающих участие в образовании ковалентных связей, до 3, 5 или 7
Особенности атомной и молекулярной структуры галогенов
Элементы группы галогенов очень сходны по свойствам, поэтому рассматриваются вместе. Несколько отличен от других фтор.
«Галогены» в переводе означает «солероды».
Действительно, все галогены — фтор F, хлор Сl, бром Вr и иод I — при непосредственном взаимодействии с металлами образуют соли. Галогеном является и астат At, открытый в 1940 г.
Электронные конфигурации галогенов:
- F — 1s22s22p5;
- Cl — 1s22s22p63s23p5;
- Br — 1s22s22p63s23p63d104s24p5;
- I — 1s2s22p63s23p63d104s24p64d105s25p5.
Таблица распределения электронов по энергетическим уровням галогенов
| Распределение электронов по энергетическим уровням галогенов в зависимости от заряда ядра | ||||||||
| Галоген | Атомный вес | Заряд ядра | Число электронов | Величина атомного радиуса,Å | ||||
| K | L | M | N | O | ||||
| Фтор F | 18,98 | +9 | 2 | 7 | 0,71 | |||
| Хлор Сl | 35,45 | + 17 | 2 | 8 | 7 | 0,99 | ||
| Бром Вr | 79,90 | + 35 | 2 | 8 | 18 | 7 | 1,14 | |
| Иод I | 126,90 | +53 | 2 | 8 | 18 | 18 | 7 | 1,33 |
Распределение по орбиталям электронов внешнего электронного слоя у всех галогенов однотипное



Общие свойства строения галогенов
Галогены имеют много общего в строении атомов и молекул. У них завершается застройка р-оболочки внешнего слоя, поэтому все они принадлежат к числу р-элементов.
Внешнему электронному слою атомов галогенов недостает до завершения одного электрона.
Поэтому электроотрицательность у этих элементов выражена ярко и в окислительно-восстановительных реакциях они ведут себя в основном как окислители.
Молекулы галогенов состоят из д вух атомов (F2, Сl2, Вr2, l2), соединенных между собой посредством ковалентной неполярной связи.
Между атомами в молекулах галогенов возникает одна общая электронная пара. Это свидетельствует о том, что в простых веществах данные элементы одновалентны.
Кристаллическая решетка галогенов молекулярного типа.
Атомы разных галогенов различаются числом электронных слоев, в связи с чем радиусы атомов галогенов различны (табл.).
С возрастанием зарядов ядер радиусы атомов увеличиваются, что ведет к постепенному уменьшению величины электроотрицательности от фтора к иоду и снижению неметалличности свойств.
Наиболее ярко выраженным неметаллом среди галогенов является фтор, наименее ярким — йод.
Вопросы и ответы на прочитанный материал
- Как меняется величина атомного радиуса в зависимости от возрастания заряда ядра атома?
- Какого типа химическая связь в молекулах галогенов?
- Какого типа кристаллическая решетка у галогенов?
- Какова валентность галогенов в свободном состоянии?
- Почему при образовании молекулы галогена между атомами возникает лишь одна электронная пара?
- Как меняется величина электроотрицательности с возрастанием радиусов атомов? (См. Ответ)
Физические свойства галогенов
Все свойства галогенов, как физические, так и химические, зависят от строения атомов элементов.
Эти свойства различных галогенов во многом сходны, но в то же время каждому галогену присущ ряд особенностей.
Фтор
Фтор это газ светло-зеленого цвета, отличающийся чрезвычайно ядовитыми свойствами. Температура кипения фтора —188°, температура затвердевания —218°. Плотность 1,11 г/см3.
Хлор
Хлор это газ желто-зеленого цвета. Он также ядовит, имеет резкий, удушливый, неприятный запах. Хлор тяжелее воздуха, сравнительно хорошо растворяется в воде (на 1 объем воды 2 объема хлора).
Образуя хлорную воду; Cl2agi при температуре— 34° превращается в жидкость, а при— 101° затвердевает. Плотность 1,568 г/см3.
Бром
Бром это единственный жидкий неметалл. Это вещество красно-бурого цвета, тяжелое, летучее. Сосуд, в котором находится бром, всегда окрашен его парами в красно-бурый цвет.
Бром имеет тяжелый неприятный запах («бром» в переводе на русский язык значит «зловонный»). В воде растворяется плохо, образуя бромную воду HBrO и HBr.
Гораздо лучше бром растворяется в органических растворителях — бензоле, толуоле, хлороформе.
Если к бромной воде прилить небольшое количество бензола и хорошенько взболтать, то после расслаивания жидкостей можно заметить, как окраска бромной воды исчезает.
А собравшийся наверху бензол окрашивается растворенным бромом в ярко-оранжевый цвет.
Это объясняется тем, что бензол извлек из воды бром вследствие его лучшей растворимости в бензоле.
Хранят бром в склянках с притертыми пробками и притертыми колпаками. Резиновые пробки для работы с бромом, как и для работы с хлором, неприменимы, так-как они быстро разъедаются.
Бром намного тяжелее воды (плотность 3,12 г/см3). Температура кипения брома 63°, температура затвердевания —7,3°.
Все галогены обладают очень резким запахом. Вдыхание их даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек.
Более значительные количества галогенов могут вызвать тяжелое отравление.
Молекулы простых веществ, образуемых атомами галогенов, двухатомны. С увеличением в ряду F, Сl, Вr, I, At радиуса атомов возрастает поляризуемость молекул.
В результате усиливается межмолекулярное дисперсионное взаимодействие, что обусловливает возрастание температур плавления и кипения галогенов.
В ряду Сl2 — Вr2 — I2 прочность связи между атомами в молекуле постепенно уменьшается, что находит отражение в уменьшении энтальпии диссоциации молекул Э2 на атомы.
Причины этого заключаются в следующем. С увеличением размеров внешних электронных облаков взаимодействующих атомов степень их перекрывания уменьшается, а область перекрывания располагается все дальше от атомных ядер.
Поэтому при переходе от хлора к брому и иоду притяжение ядер атомов галогена к области перекрывания электронных облаков уменьшается.
Кроме того, в ряду Cl — Вr — I возрастает число промежуточных электронных слоев, экранирующих ядро, что также ослабляет взаимодействие атомных ядер с областью перекрывания.
Уменьшение прочности связи в молекулах галогенов проявляется в падении их устойчивости к нагреванию, при одной и той же температуре степень термической диссоциации молекул возрастает при переходе от Сl2 к Вr2 и I2.
Однако из этих же данных следует, что фтор выпадает из общей закономерности:
- Прочность связи между атомами в его молекуле меньше.
- А степень термической диссоциации молекул выше, чем у хлора.
Такие аномальные свойства фтора можно объяснить отсутствием d-подуровня во внешнем электронном слое его атома.
В молекуле хлора и других галогенов есть свободные d-орбитали, и поэтому между атомами имеет место дополнительное донорно акцепторное взаимодействие, упрочняющее связь.
Галогены сравнительно мало растворимы в воде. Один объем воды растворяет при комнатной температуре около 2,5 объемов хлора.
Раствор этот называется хлорной водой. При пропускании хлора в охлажденную до 0 °С воду из раствора выделяются зеленовато-желтые кристаллы клатратного соединения Сl2 • 8Н2О.
Растворимость брома при 20 °С составляет около 3,5 г, а растворимость иода всего 0,02 г на 100 г воды.
Фтор не может быть растворен в воде, так как энергично разлагает ее:
2F2 + 2Н2О = 4HF + O2↑
Значительно лучше, чем в воде, бром и иод растворяются в органических растворителях: сероуглероде, этиловом спирте, диэтиловом эфире, хлороформе, бензоле.
Этим пользуются для извлечения брома и иода из водных растворов.
Если, например, взболтать водный раствор иода с небольшим количеством сероуглерода (не смешивающегося с водой), то почти весь иод перейдет из воды в сероуглерод, окрашивая его в фиолетовый цвет.
Иод
Йод это кристаллическое вещество, темно-серого цвета, в парах — фиолетового. Плотность йода 4,93 г/см3, температура плавления 113°, температура кипения 184°.
Довести йод до плавления, а тем более до кипения при обычных условиях не удается, так как уже при слабом нагревании он из твердого состояния сразу переходит в пар —возгоняется.
Переход вещества из твердого состояния в газообразное, минуя жидкое, и обратно называется возгонкой.
Это свойство характерно не только для йода, но и для некоторых других веществ. Его удобно использовать для очистки веществ от примесей.
Иод плохо растворяется в воде. Окраска йодной воды I2aq всегда светло-желтая. Но зато он прекрасно растворяется в спирте.
Этим пользуются для приготовления 5—10% раствора иода в спирте, называемого йодной настойкой.
Иод растворяется также в бензоле, толуоле, эфире, сероуглероде и других органических растворителях.
Интересно, что иод очень хорошо растворяется в растворе собственных солей, например в йодистом калии.
Этот раствор, называемый раствором Люголя, широко применяется в клинических лабораториях.
Если в йодную воду I2aq добавить немного бензола, то при встряхивании на поверхности также образуется окрашенное бензольное кольцо, но только малинового цвета.
Вопросы и ответы на прочитанный материал
- Как меняется интенсивность окраски галогенов с возрастанием зарядов ядер?
- Какое название имеют растворы хлора, брома и иода в воде?
- Как меняется плотность галогенов с возрастанием зарядов ядер? (См. Ответ)
- Составьте и заполните таблицу «Физические свойства галогенов» по следующему образцу:
- Как объяснить с точки зрения строения кристаллической решетки низкие температуры плавления и кипения галогенов?
- Какова относительная плотность фтора и хлора по воздуху и водороду? Если вы не знаете, что такое относительная плотность газов, как она определяется и как ею пользоваться при расчетах, . После этого вы сможете ответить на вопрос.
- Какой объем займут 20 кг хлора при нормальных условиях? Если вы забыли, как вычислять объем газа при нормальных условиях, обратитесь к приложению. (См. Ответ)
Физиологическое действие галогенов
Все галогены ядовиты по своему физиологическому действию. Особенно ядовит фтор: при вдыхании в небольших количествах он вызывает отек легких, в больших — разрушение легочной ткани и смерть.
Хлор
Хлор — также вещество очень ядовитое, хотя в несколько меньшей степени. Во время первой мировой войны он применялся как боевое отравляющее вещество.
Потому что он тяжелее воздуха и хорошо удерживается над поверхностью земли, особенно при безветренной погоде. Предельно допустимая концентрация свободного хлора в воздухе 0,001 мг/л.
Хроническое отравление хлором вызывает изменение цвета лица, легочные и бронхиальные заболевания.
При отравлениях хлором в качестве противоядия нужно применять смесь паров спирта с эфиром, а также водяных паров с примесью нашатырного спирта, причем предварительно обязательно вынести пострадавшего на свежий воздух.
В небольших же количествах хлор может излечивать заболевания верхних дыхательных путей, так как губительно действует на бактерии.
Благодаря дезинфицирующему действию хлор применяется для обеззараживания водопроводной воды.
Бром
Пары брома вызывают удушье. Ядовит и жидкий бром, причиняющий при попадании на кожу сильные ожоги.
Переливать бром из одного сосуда в другой рекомендуется в резиновых перчатках и под тягой.
При попадании на кожу бром следует смывать органическим растворителем — бензолом или четыреххлористым углеродом, протирая пораженное место ватой, смоченной этими растворителями.
При смывании брома водой нередко ожога избежать не удается.
Иод
Иод наименее ядовит из всех галогенов. Вдыхание паров иода при его нагревании может вызвать отравление, но работать с парообразным иодом приходится редко, например при очистке его возгонкой.
Кристаллический иод руками брать не следует, так как при попадании на кожу он вызывает появление характерных желтых пятен. Все работы с галогенами следует производить в вытяжном шкафу.
Вместе с тем галогены являются жизненно важными элементами. Хлор в виде поваренной соли постоянно применяется в пищу, а также входит в состав зеленого вещества растений — хлорофилла.
Недостаток соединений фтора в питьевой воде вызывает разрушение зубов. Иод необходим всем живым организмам, как растительным, так и животным. Он участвует в регулировании обмена веществ.
В организме человека иод сосредоточен главным образом в щитовидной железе и участвует в образовании ее гормона. Недостаток иода вызывает болезненные изменения щитовидной железы.
Для предотвращения заболевания в пищу в очень небольших количествах добавляют иод, разводя несколько капель йодной настойки на стакан воды, но чаще в виде иодида натрия и иодида калия.
• Запишите в тетрадь меры техники безопасности в работе с галогенами и первой помощи при отравлениях.
Химические свойства галогенов
По характеру химических свойств, как отмечено выше, все галогены являются типичными неметаллами, обладающими значительной электроотрицательностью.
Наиболее электроотрицательным элементом, обладающим наибольшей неметаллической активностью, является фтор, наименее активен иод.
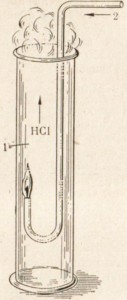
Рис. 21. Горение водорода в хлоре. 1- хлор 2- водород
Взаимодействие галогенов с простыми веществами. Проследить уменьшение химической активности от фтора к хлору можно на примерах разных реакций.
Особенно интересно взаимодействие разных галогенов с водородом. Условия реакций у них при этом разные.
Так, фтор реагирует с водородом со взрывом даже в темноте. При этом образуется фтористый водород по уравнению.
H2 + F2 = 2HF
Фтористый водород является наиболее прочным соединением среди галогеноводородов.
Взаимодействие хлора с водородом происходит со взрывом только на свету:
Сl2 + Н2 = 2НСl
Если же поджечь струю водорода в атмосфере хлора, то он будет сгорать спокойно бесцветным пламенем (рис. 21).
С водородом бром образует бромистый водород.
Вr2 + Н2 = 2НВr
Процесс идет при слабом нагревании.
Иод с водородом реагирует только при нагревании с образованием йодистого водорода:
Н2 + I2 = 2НI
Однако это соединение весьма неустойчивое и легко распадается с образованием водорода и иода. Во всех этих случаях галогены ведут себя как окислители.
Галогено-водороды при растворении в воде образуют кислоты.
Свободные галогены проявляют чрезвычайно высокую химическую активность. Они вступают во взаимодействие почти со всеми простыми веществами.
Особенно быстро и с выделением большого количества теплоты протекают реакции соединения галогенов с металлами.
Так, расплавленный металлический натрий в атмосфере хлора сгорает с ослепительной вспышкой, а на стенках сосуда появляется белый налет хлорида натрия:
2Na + Cl2 = 2NaCl
Медь, железо, олово и многие другие металлы сгорают в хлоре, образуя соответствующие соли.
Подобным же образом взаимодействуют с металлами бром и иод.
Во всех этих случаях атомы металла отдают электроны, т. е. окисляются, а атомы галогенов присоединяют электроны, т. е. восстанавливаются.
Эта способность присоединять электроны, резко выраженная у атомов галогенов, является их характерным химическим свойством.
Следовательно, галогены — очень энергичные окислители.
Окислительные свойства галогенов проявляются также и при взаимодействии их со сложными веществами.
Примеры окислительных свойств галогенов
1. При пропускании хлора через раствор хлорида железа (II) последний окисляется в хлорид железа (III), вследствие чего раствор из бледно-зеленого становится желтым:
2FeCl2 + Сl2 = 2FeCl3
2. Если к желтоватому водному раствору иода добавить сероводородной воды (водный раствор H2S), то жидкость обесцвечивается и и становится мутной от выделившейся серы:
H2S + I2 = S↓ + 2HI
3. При действии водного раствора брома на раствор сульфита натрия Na2SO3 происходит обесцвечивание раствора, так как бром окисляет сульфит до сульфата натрия, а сам восстанавливается, превращаясь в бесцветный бромоводород.
Реакция протекает при участии молекул воды и выражается уравнением:
Na2SO3 + Вr2 + Н2О = Na2SO4 + 2НВr
или в ионно-молекулярной форме:
SO23— + Вr2 + Н2О = SO24— + 2Н+ + 2Вr—
Химическая активность фтора исключительно высока.
По образному выражению академика А. Е. Ферсмана, фтор можно назвать «всесъедающим».
Щелочные металлы, свинец, железо загораются в атмосфере фтора при комнатной температуре.
На некоторые металлы (Сu, Ni) фтор на холоду не действует, так как на их поверхности образуется защитный слой фторида.
Однако при нагревании фтор реагирует со всеми металлами, в том числе с золотом и платиной.
Со многими неметаллами (водород, иод, бром, сера, фосфор, мышьяк, сурьма, углерод, кремний, бор) фтор взаимодействует на холоду; реакции протекают со взрывом или с образованием пламени:
Н2 + F2 = 2HF + 541,4 кДж
Si + 2F2 = SiF4 + 1615 кДж
S + 3F2 = SF6 + 1207 кДж
При нагревании с фтором соединяются хлор, криптон и ксенон, например:
Хе + F2 = XeF2 + 176 кДж
Непосредственно фтор не реагирует только с кислородом, азотом и углеродом (в виде алмаза).
Очень энергично протекает взаимодействие фтора со сложными веществами.
В его атмосфере горят такие устойчивые вещества,, как стекло (в виде ваты) и водяной пар:
SiO2 + 2F2 = SiF4 + О2 + 657 кДж
2Н2О + 2F2 = 4HF + О2 + 598 кДж
Интересно отметить, что при реакции воды со фтором в качестве одного из продуктов горения образуется кислород.
Свободный хлор тоже проявляет очень высокую химическую активность, хотя и меньшую, чем фтор.
Он непосредственно взаимодействует со всеми простыми веществами, за исключением Кислорода, азота и благородных газов.
Такие неметаллы, как фосфор, мышьяк, сурьма и кремний, уже при низкой температуре реагируют с хлором; при этом выделяется большое количество теплоты.
Энергично протекает взаимодействие хлора с активными металлами — натрием, калием, магнием и др.
При комнатной температуре без освещения хлор практически не взаимодействует с водородом, но при нагревании или на ярком солнечном свету реакция протекает по цепному механизму со взрывом.
Химическая активность брома и иода меньше, чем хлора, но все же велика. Со многими металлами и неметаллами (например, с фосфором) они реагируют в обычных условиях.
При этом бром по активности мало уступает хлору, а иод отличается от хлора значительно.
Взаимодействие брома с водородом происходит лишь при нагревании.
Иод с водородом реагирует только при достаточно сильном нагревании и не полностью, так как начинает идти обратная— реакция — разложение иодоводорода:
H2 + I2 ⇄ 2HI —53,1 кДж
Сравнение химических свойств галогенов показывает, что их окислительная активность последовательно уменьшается от фтора к астату.
Этот эффект проявляется в способности более легких галогенов в виде простых веществ, окислять галогенид-ионы более тяжелых галогенов и в способности более тяжелых галогенов восстанавливать кислородные соединения более легких галогенов:
F2 + 2Cl— → 2F— + Cl2
CI2 + 2Вr— → 2Сl + Вr2
Вr2 + 2I— → 2Вr— + I2
I2 + 2ClO—3→ 2IO—3 + Cl2
Несмотря на меньшую энергию сродства к электрону у фтора, чем у хлора , фтор является все же самым сильным окислителем среди галогенов. Объясняется это следующим.
Превращение газообразного хлора или фтора в отрицательно заряженные ионы можно рассматривать как состоящее из двух стадий — диссоциации молекул на отдельные атомы:
1/2Э2 → Э
и присоединения электрона к образовавшемуся свободному атому галогена:
Э + e— → Э—
Первая стадия процесса требует затраты энергии на разрыв связей между атомами галогена в молекуле; мерой этих энергетических затрат может служить энтальпия диссоциации молекул галогена.
У хлора, состоящего из более прочных молекул, энтальпия диссоциации в расчете на 1 моль атомов галогена (121,5 кДж/моль) значительно выше, чем у фтора (79,5 кДж/моль).
Вторая стадия процесса сопровождается выделением энергии (сродство к электрону); здесь выигрыш энергии в случае хлора (348,7 кДж/моль) несколько выше, чем в случае фтора (332,7 кДж/моль).
Как нетрудно подсчитать, общий выигрыш энергии в рассматриваемом процессе для фтора (253,2 кДж/моль) выше, чем для хлора (227,2 кДж/моль), что и характеризует фтор как более сильный окислитель.
Если реакция протекает в водном растворе, то следует учесть и энергию гидратации галогенид-ионов; при одинаковом заряде иона она тем выше, чем меньше радиус иона.
Следовательно, при гидратации фторид-иона F- выделяется больше энергии, чем при гидратации иона Сl—, так что и в водных растворах фтор будет более сильным окислителем, чем хлор.
Аналогичные расчеты показывают, что при переходе от хлора к брому и иоду выигрыш энергии в окислительных процессах, протекающих в водных растворах с участием галогенов, также уменьшается.
Этим и объясняется способность каждого галогена вытеснять более тяжелые галогены, находящиеся в степени окисленности—1, из растворов их соединений.
Фтор и хлор со многими органическими растворителями интенсивно реагируют.
Окислительные свойства галогенов
Окислительные свойства галогены проявляют и при взаимодействии с металлами, которое протекает обычно очень активно.
Фтор реагирует практически почти со всеми металлами. Легко проследить взаимодействие хлора с металлами.
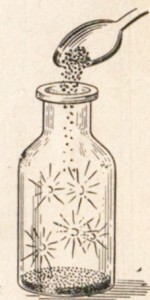
Многие металлы в хлоре горят, например сурьма самовоспламеняется (рис. 22). Другие металлы реагируют с хлором при нагревании, например натрий (рис. 23).
2Na + Сl2 = 2NaCl
Если металлы могут иметь различную степень окисления, то при реакции с хлором они обычно проявляют высшую.
Рис. 22. Самовоспламенение сурьмы в хлоре
Примеры реакций галогенов с металлами
2Fe + 3Сl2 = 2FeCl3
Сu + Сl2 = СuСl2
Здесь железо в реакции с хлором проявляет степень окисления, равную +3 — Fe+3, а медь равную +2— Cu+2. Во всех приведенных случаях хлор ведет себя как окислитель .
Бурно реагирует с металлами и бром. Если насыпать в пробирку с жидким бромом немного алюминиевых опилок.
То они сгорают в броме с образованием бромистого алюминия, что сопровождается выделением бурых паров брома и снопом искр. Реакция идет по следующему уравнению:
2Аl + ЗВr2 = 2АlВr3

Опыт производится в приборе, изображенном на рис. 24. Длинная трубка 1 выполняет роль воздушного холодильника.
Горят в броме также олово, сурьма, а калий с бромом дает сильный взрыв.
Рис. 22. Самовоспламенение сурьмы в хлоре
Иод также реагирует с металлами, образуя йодистые соли. Особенно интересно происходит реакция алюминия с иодом.
Для этого кристаллы иода растирают в ступке до образования мелкого порошка, а затем на асбестированной сетке смешивают иод с алюминиевой пылью.
Смесь, посуда и материалы должны быть совершенно сухими.
Если после этого добавить к смеси каплю воды, которая является катализатором в этом процессе, то смесь воспламеняется и горит, выделяя фиолетовые клубы паров иода:
2Аl + 3I2 = 2АlI3
Следует отметить, что иод реагирует с металлами труднее, чем хлор и бром.
В отличие от большинства других простых веществ галогены в непосредственное взаимодействие с кислородом не вступают, так как кислород и галогены обладают близкими значениями электроотрицательности.
Вместе с тем кислородные соединения галогенов косвенным путем получены и существуют.

Рис. 23. Горение натрия в хлоре.
1- металлический натрий
2- хлоркальциевая трубка
3- хлор
4- едкий калий
- Докажите путем составления электронного баланса, что в реакциях с водородом и металлами галогены ведут себя как окислители. Обоснуйте такое поведение строением атома галогенов.
- Какой объем хлористого водорода может быть получен при реакции с водородом 20 л хлора? (эта задача решается целиком в объемах).
- Для того чтобы образующийся хлористый водород не был загрязнен хлором, при взаимодействии хлора с водородом последнего берут на 5% больше требуемого количества. Рассчитайте, какой объем водорода следует взять для получения 50 л хлористого водорода. (См. Ответ)
Галогены в природе. Физические свойства галогенов.
Галогены, вследствие их большой химической активности, находятся в природе исключительно в связанном состоянии — главным образом в виде солей галогеноводородных кислот.
Фтор встречается в природе чаще всего в виде минерала плавикового шпата СаF2, получившего это название потому, что его прибавление к железным рудам приводит к образованию легкоплавких шлаков при выплавке чугуна.
Фтор содержится также в минералах криолите Na3AlF6 и фторапатите Ca5F(PO4)3.
Важнейшим природным соединением хлора является хлорид натрия (поваренная соль) NaCl, который служит основным сырьем для получения других соединений хлора.
Главная масса хлорида натрия находится в воде морей и океанов.
Воды многих озер также содержат значительное количество NaCl— таковы, например; в озера Эльтон и Баскунчак.
Хлорид натрия встречается также и в твердом виде, образуя местами в земной коре мощные пласты так называемой каменной соли.
В природе распространены и другие соединения хлора, например хлорид калия в виде минералов карналлита КСl•MgCl2•6H2O и сильвина КСl.
Хлор под давлением около 0,6 МПа уже при комнатной температуре превращается в жидкость.
Сжиженный хлор обычно хранят и транспортируют в стальных баллонах или цистернах.
Подобно хлору бром находится в природе преимущественно в виде солей калия, натрия и магния.
Бромиды металлов содержатся в морской воде, в воде некоторых озер и в подземных рассолах.
В нашей стране содержание брома в подземных буровых водах, имеющих промышленное значение, составляет от 170 др 700 мг/л.
Соединения иода также имеются в морской воде, но в столь малых количествах, что непосредственное выделение их из воды очень затруднительно.
Однако существуют некоторые водоросли, которые накапливают иод в своих тканях. Зола этих водорослей служит сырьем для получения иода.
Значительные количества иода (от 10 до 50 мг/л) содержатся в подземных буровых водах.
Иод встречается также в виде солей калия — йодата КIO3 и перйодата КIO4, сопутствующих залежам нитрата натрия (селитры?) в Чили п Боливии.
Иод при комнатной температуре представляет собой темно-фиолетовые кристаллы со слабым блеском.
При нагревании под атмосферным давлением он сублимируется (возгоняется), превращаясь в пар фиолетового цвета; при охлаждении пары иода кристаллизуются, минуя жидкое состояние.
Этим пользуются на практике для очистки иода от нелетучих примесей.
Самый тяжелый галоген — астат — в природе практически не встречается. Его получают путем искусственно осуществляемых ядерных реакций.
Наиболее долгоживущий изотоп астата 210At имеет период полураспада всего 8,3 ч. Ничтожные количества астата обнаружены в продуктах естественного радиоактивного распада урана и тория.
Получение галогенов
В природных соединениях галогены содержатся (за редким исключением) в виде отрицательно заряженных ионов, поэтому почти все способы получения свободных галогенов сводятся к окислению их ионов.
Это осуществляется или при помощи окислителей, или действием электрического тока.
Получение фтора
Фтор, вследствие своей высокой электроотрицательности, может быть выделен из соединений только путем электролиза.
Впервые он был получен в 1886 г. путем разложения электрическим током смеси безводного жидкого фтороводорода с KF.
Этот метод применяется в настоящее время для промышленного получения фтора. Расплав состава KF + 2HF (температура плавления 70 °С) подвергают электролизу.
Электролиз ведут в никелевом сосуде, который является катодом, а анодом служит уголь.
Катодное и анодное пространства разделены диафрагмой для предотвращения взрыва при смешивании продуктов электролиза — водорода и фтора.
Получение хлора
Хлор получают в настоящее время в больших количествах путем электролиза водных растворов хлоридов натрия или калия.
Хлор выделяется у анода, а у катода образуется соответственно гидроксид натрия или калия.
В лабораториях хлор получают действием различных окислителен на соляную кислоту.
Напомним, например, известный из школьного курса лабораторный способ получения хлора действием диоксида марганца на соляную кислоту:
MnO2 + 4HCI = MnCl2 + СІ2 + 2Н2О
В ионно-молекулярной форме эта реакция выразится уравнением
МnО2 + 2Сl— + 4Н+ = Мn2+ + Сl2 + 2Н2О
из которого видно, что здесь происходит окисление ионов Сl—в атомы хлора (образующие затем молекулы Cl2) и восстановление марганца, входящего в состав МnО2, до степени окисленности +2 (ионы Мn2+).
При помощи этой реакции хлор был впервые получен К. В. Шееле (Швеция) в 1774 г.
Получение хлора из соляной кислоты
Аналогично можно получить хлор из соляной кислоты, действуя на нее такими окислителями, как РbO2, КСlО3, КМnО4.
Кислород в обычных условиях не взаимодействует с НСІ в сколько-нибудь заметной степени.
Но если пропускать НСl и О2 через трубку, нагретую до 400 °С и содержащую кусочки пемзы, на которых распределен в качестве катализатора хлорид меди (II) СuСl2, то происходит окисление хлороводорода кислородом:
4НСl + О2 ⇄ 2Сl2 + 2Н2О
причем выход хлора достигает 80%. Этой реакцией раньше пользовались для промышленного получения хлора.
Получение брома и иода
Бром и иод могут быть получены аналогично хлору окислением НВr и HI различными окислителями. В промышленности их обычно получают из бромидов или иодидов, действуя на их растворы хлором.
Таким образом, получение брома и иода тоже основано на окислении их ионов, причем в качестве окислителя применяется хлор.
Бром добывают главным образом из подземных буровых вод, а также из «рапы» (насыщенного раствора) некоторых соляных озер.
Главным источником получения иода в СНГ служат подземные буровые воды.
Применение галогенов
Галогены, особенно хлор, широко применяются в химической промышленности.
Фтор используют для получения некоторых ценных фторопроизводных углеводородов, обладающих уникальными свойствами.
Как, например, смазочных веществ, выдерживающих высокую температуру, пластической массы, стойкой к химическим реагентам (тефлон), жидкостей для холодильных машин (фреонов, или хладонов).
Применение хлора
Хлор служит для приготовления многочисленных неорганических и органических соединений. Его применяют в производстве соляной кислоты, хлорной извести, гипохлоритов и хлоратов и др.
Большое количество хлора используется для отбелки тканей и целлюлозы, идущей на изготовление бумаги. Хлор применяют также для стерилизации питьевой воды и обеззараживания сточных вод.
В цветной металлургии его используют для хлорирования руд, которое является одной из стадий получения некоторых металлов.
Особенно большое значение приобрели за последнее время различные хлорорганические продукты.
Хлорсодержащие органические растворители — например, дихлорэтан, четыреххлористый углерод — широко применяются для экстракции жиров и обезжиривания металлов.
Некоторые хлорорганические продукты служат эффективными средствами борьбы с вредителями сельскохозяйственных культур.
На основе хлорорганических продуктов изготовляют различные пластические массы, синтетические волокна, каучуки, заменители кожи (павинол).
С развитием техники область применения хлорорганических продуктов расширяется; это ведет к непрерывному увеличению производства хлора.
Широкое использование хлора в различных отраслях народного хозяйства, а также масштабы его производства и потребления позволяют отнести хлор, наряду с серной кислотой, аммиаком и содой, к числу важнейших продуктов, выпускаемых химической промышленностью.
Применение брома
Бром необходим для выработки различных лекарственных веществ, некоторых красителей, а также бромида серебра, потребляемого при производстве фотоматериалов.
Применение иода
Иод применяют в медицине в виде так называемой иодной тинктуры (10% раствор иода в этиловом спирте), превосходного антисептического и кровоостанавливающего средства.
Кроме того, иод входит в состав ряда фармацевтических препаратов.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.