Калий это химический элемент, простое вещество, в нормальных условиях быстро окисляется покрываясь тонким слое оксида кали.
Калий щелочной металл по своей активности быстрее чем натрий и кальций, реакция с водой может сопровождаться воспламенение и взрывом.
Применяется для получения солей на основе калия, нитрат калия, хлорид калия и д.р.
Что такое калий
(Kalium; от араб, аль-кали — поташ), К — химический элемент 1-й группы, атомный номер 19, атомная масса 39,098.4
Серебристо-белый мягкий металл. В соединениях проявляет степень окисления 0, +1.
Металлический калий впервые получил (1807), назвав его «потассием», англ. химик и физик Г. Дэви электролизом влажного едкого кали.
Название «калий» предложил в 1809 нем. физик и химик Л.-В. Гильберт.
Калий один из наиболее распространенных элементов. Содержание его в земной коре 2,5%.
В свободном состоянии в природе не встречается из-за большой хим. активности.
Входит в состав полевых шпатов, нефелина, слюд, лейцита и др. минералов, слагающих горные породы.
При воздействии воды и двуокиси углерода на горные калийсодержащие породы переходит в растворимые соединения, легко вымывающиеся водой.
Важнейшие минералы калия сильвин, карналлит, каинит KMg[Cl/SО4]•3H2О и полигалит K2Ca2Mg [SО4]4 • 2Н2О.
Физические свойства калия
Кристаллическая решетка — объемноцентрированная кубическая с периодом а = 5,33 Å.
Атомный радиус 2,36 Å, ионный радиус К+ составляет 1,33 Å. Плотность (т-ра О С) 0,8629 г/см3; ,tпл 63,41 ° С; tкип 760° С.
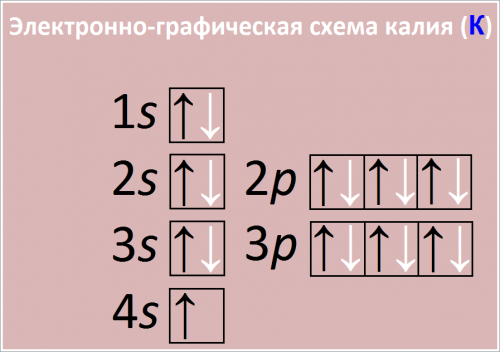
Электронная конфигурация: [Ar] 4s1
Полная электронная конфигурация 1s22s22p63s23p64s1
Рис. Схема распределения электронов по атомным орбиталям в атоме калия.
Температурный коэфф. линейного расширения твердого К. (т-ра 0—50° С) 8,33 • 10-5 град-1; температурный коэфф. объемного расширения (т-ра 70—100° С) 2,498•10-4 град-1.
Коэфф. теплопроводности (т-ра 21° С) 0,232 кал/см-сек-град) удельная теплоемкость (т-ра 20° С; 0,182 кал/г • град.
Калий отличается высокой электропроводностью. Удельное электр. сопротивление (т-ра 20° С) 6,992 10-6 ом-см.
Металлический парамагнитен. В холодном состоянии легко режется ножом, прессуется и прокатывается; НВ = 0,037.
Сжимаемость при давлении 1 бар равна 31,5 ·10-6.
Металлический на воздухе быстро окисляется, а при нагревании загорается. При взаимодействии с кислородом образует желтовато-белую окись К2О и ярко-желтую перекись КО2.
При действии кислорода на его аммиачный раствор образуются соединения К2О2 и К2О3.
На воздухе поверхность металла покрывается слоем перекиси с подстилающим слоем окиси.
При очистке поверхности калия от окислов ножом возможны сильные взрывы в результате соприкосновения перекиси металла с металлическим калием.
Химические свойства
Калий — серебристо — белый, мягкий металл, активнее натрия, хранят также под слоем керосина.
Металлический калий окисляется и горит на воздухе, непосредственно соединяется с галогенами, серой, фосфором, с некоторыми другими элементами.
С водородом при 350°C образует гидрид KH разлагаемый водой, как и гидрид натрия:
KH + H2O = H2↑ + KOH
Калий вытесняет водород из воды легче, чем натрий:
2K + 2H2O = H2↑ + 2KOH
Супероксид ( надперекись ) калия K2O4 образуется при сгорании калия в избытке кислорода.
Как и пероксид натрия, это сильный окислитель. Оксид калия K2O получают косвенным путём.
Оба соединения, взаимодействуя с водой, дают гидроксид калия:
K2O + H2O = 2KOH
2K2O4 + 2H2O = 4KOH + 3O2↑
Гидроксид калия (едкое кали) KOH в технике получают электролизом водного раствора хлорида калия.
Это твёрдое кристаллическое вещество, похожее на гидроксид натрия, оно гигроскопично, разрушает животные и растительные ткани.
Главные потребители гидроксида калия — мыловаренная промышленность, производство карбоната калия K2CO3 и хлората калия KClO3.
Почти все соли калия хорошо растворимы в воде, но в отличие от солей натрия не содержат кристаллизационной воды.
В месте с азотом и фосфором калий — один из основных элементов питания растений, при отсутствии его они погибают.
Изотопы
Природный калий состоит из стабильных изотопов 39К (93,08%), 41К (6,91%) и одного слабо радиоактивного изотопа 40К (0,01%) с периодом полураспада-1,32 • 109 лет.
Из искусственных радиоактивных изотопов наибольшее значение имеет изотоп 42К с периодом полураспада 12,52 года.
Соединения калия с веществами
С водородом при нагревании до т-ры 200° С практически не взаимодействует, а при более высокой т-ре образуются белые кристаллы гидрида KH, легко воспламеняющиеся на воздухе.
С азотом калий не реагирует даже при сравнительно высокой т-ре и давлении.
Однако при воздействии калия в среде азота электр. разрядов образуются бесцветные кристаллы азида KN3 и небольшое количество нитрида KNO2.
При взаимодействии с галогенами калий образует соответствующие соли:
- Фторид KF.
- Хлорид КСl.
- Бромид КВr.
- Йодид KI.
При нагревании с серой образуется сульфид K2S — твердое кристаллическое вещество белого цвета, гигроскопичное и постепенно разлагающееся на воздухе.
С теллуром и селеном образует соответственно теллурид К2Те и селенид K2Se. Известны различного состава кристаллические соединения с углеродом (карбиды).
Все карбиды калия исключительно реакционноспособны, на воздухе окисляются, бурно реагируют с кислородом и водой.
С кремнием образует силициды состава KSi и KSi8.
Известны соединения с фосфором, мышьяком и бором.
Растворимость калия веществах
Калий растворяется в воде, охлажденной до т-ры 0° С и не содержащей кислорода. Однако с водой, имеющей более высокую т-ру, калий реагирует со взрывом; при этом образуется гидроокись КОН и выделяется водород.
Металл растворяется в жидком аммиаке, тетрагидрофуране, диглиме и др. эфирах. Все эти растворы — голубого цвета различной интенсивности.
Калий хорошо растворяется во многих металлах, с ртутью образует амальгамы.
В гидроксильной группе спиртов замещает водород, образуя соответствующие алкоголяты.
Эту особенность используют, в частности, для уничтожения небольших остатков щелочных металлов.
Калий способствует полимеризации олефинов и диолефинов, замещает галогены в галогеналкилах и галогенарилах, образуя калий-алкилы и калий-арилы.
Взаимодействие с хлорированными органическими соединениями, например с четыреххлористым углеродом, происходит со взрывом.
Получение калия
В промышленных масштабах калий получают электролизом расплавов едкого кали или кислородных солей металла в расплавленных галогенидах.
Используют также обменные реакции взаимодействия фторида калия с карбидом кальция, жидкого натрия с расплавом едкого кали (при т-ре 380— 410° С).
Или взаимодействие между парами натрия и расплавом хлорида при т-ре 760—800° С.
Применение
Металлический калий используют для получении его надперекиси, применяемой для регенерации кислорода в замкнутых пространствах.
Например в подводных лодках.
Для восстановления титана из его солей (TiCl4) при высокой т-ре; в различных газоразрядных приборах.
Пары калия находят применение в магнитогидродинамических генераторах — установках, непосредственно преобразующих тепловую энергию в электрическую.
Сплавы натрия и калия используют как теплоносители в ядерных реакторах, как рабочее тело в спец. транспортных энергетических установках и для поглощения кислорода.
Соли редко образуют крупные месторождения. Наиболее распространены минералы сильвинит KCl · NaCl , карналлит KCl · MgCl2 · 6H2O , каинит KCl · MgSO4 · 3H2O.
Калий и растения
Большое количество калия уходит из почвы с урожаем подсолнечника, льна, конопли, накапливающих его в своих стеблях и поэтому калий находиться в продуктах.
Калий участвует в процессе фотосинтеза, недостаток его в почве понижает интенсивность фотосинтеза.
Приводит к снижению содержания сахара в корнеплодах свеклы и крахмала в зерне, отмиранию листьев растений.
Повышение восприимчивости к грибкам и бактериальным заболеваниям, снижение схожести семян.
Различают доступный для растений обменный калий почвы и недоступный — необходимый , входящий в состав силикатов и алюмосиликатов.
Обычно доступного для растений калия в почве недостаточно: поэтому для получения высоких урожаев (особенно сахарной свеклы и картофеля) вносят калийные удобрения.
Соли калия
Хлорид калия KCl — наиболее концентрированное калийное удобрение. Добывают его из руд — сильвинита и карналлита.
Нитрат калия ( калийная селитра ) KNO3 — содержит два элемента питания растений — калий и азот .
Такое удобрение называют сложным.
Получают нитрат калия в результате обменной реакции:
KCl + NaNO3 = KNO3 + NaCl
Отделяют нитрат калия от хлорида натрия, пользуясь их различной растворимостью. Его используют также в производстве тугоплавкого стекла и чёрного пороха.
Метафосфат калия KPO3 — сложное удобрение, содержащее два элемента питания растений — калий и фосфор.
Сульфат калия K2SO4 — получают из природных калийных солей и применяют как удобрение.
Карбонат калия ( или поташ ) K2CO3 — раньше выделяли из золы растений, сейчас получают при пропускании двуокиси углерода через раствор гидроксида калия.
Карбонат калия используют как калийное удобрение.
Другие соединения калия: гидроксид калия, перманганат калия, дихромат калия, уксуснокислый калий.
Статья на тему калий


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.