Свинец это химический элемент, простое вещество, мягкий, серебристо-белый или сероватый металл.
Свинец является плохим проводником электричества и очень пластичен и плотен.
Известный с древности и считающийся алхимиками древнейшим металлом, чрезвычайно долговечен и обладает высокой коррозионной активностью.
О чем свидетельствует продолжающееся использование свинцовых водопроводных труб, установленных древними римлянами.
Плотность свинца составляет 11,29 г/см3, а +4 и +2 — степени окисления свинца.
Что такое свинец
(Plumbum), Pb — химический элемент принадлежащий к 14-й группе, 6-му периоду периодической системы элементов, (устаревшая IV группы периодической системы элементов).
Атомный номер 82, атомная масса 207,2.
Синевато-серый металл. В соединениях проявляет степени окисления +2 и +4.
Свинец известен с давних времен. Египтяне выплавляли его за 5 — 7 тыс. лет до н. э. Римляне изготовляли из свинца водопроводные трубы.
Pb — это аббревиатура латинского слова plumbum, и это символ свинца, что означает «свинец».
Содержание свинца в земной коре 1,0 · 10 4%.
Самородный свинец в природе не встречается. Важнейший минерал — галенит, содержащийся преимущественно в сульфидных полиметаллических рудах.
Кристаллическая решетка гранецентрированная кубическая с периодом а = 4,9495 А.
История
В ранних библейских повествованиях часто упоминается свинец (Pb). Вавилоняне использовали металл для записи надписей на табличках.
Римляне использовали его для изготовления табличек, водопроводных трубок, монет и даже кухонной утвари; действительно, отравление свинцом было признано во времена Августа Цезаря в результате последнего использования.
Соединение, известное как свинцовые белила, как сообщается, производилось в качестве декоративного пигмента еще в 200 году до нашей эры.
В конце 1700-х годов началась разработка месторождений в регионе Миссури-Канзас-Оклахома в США, что привело к современным достижениям.
Распространение
По весу свинец почти так же распространен в земной коре, как олово. Во Вселенной на каждые 106 атомов кремния приходится 0,47 атома свинца.
Цезий, празеодим, гафний и вольфрам имеют космическое относительное содержание, сравнимое с цезием, празеодимом, гафнием и вольфрамом.
Несмотря на то, что свинец встречается редко, естественные процессы концентрирования привели к образованию значительных коммерческих месторождений, особенно в Соединенных Штатах.
А также в Канаде, Австралии, Испании, Германии, Африке и Южной Америке. Западные штаты и долина Миссисипи в Соединенных Штатах имеют значительные залежи.
Свинец присутствует в различных минералах, но редко встречается в природе в свободном виде.
За исключением сульфида, PbS (галенита, или свинцового блеска), который является основным мировым источником производства свинца.
Англезит (PbSO4) и церуссит содержат свинец (PbCO3).
В начале 20-го века основными производителями свинца в концентрате были Китай, Австралия, Соединенные Штаты, Перу, Мексика и Индия.
Обжиг руды и последующая ее плавка в доменной печи или прямая плавка без обжига — вот два способа извлечения свинца.
Примеси в свинцовых слитках, полученных любым способом, удаляются путем дальнейшего рафинирования.
На переработанный лом приходится почти половина всего очищенного свинца. 11,29 грамма/см3 — это плотность свинца. Символ свинца — Pb.
Физические свойства свинца
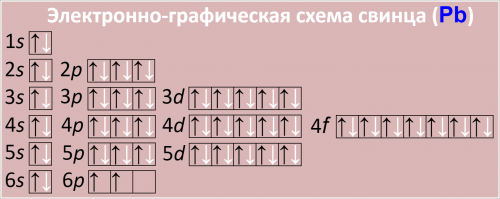
Сокращенная электронная конфигурация Pb:
4f145d106s26p2.
Плотность чистого металла 11,34 г/см3; tпл 327,4° С; tкип1740° С; скрытая теплота плавления 6,26 кал/г; скрытая теплота испарения 201 кал/г.
Температурный коэфф. линейного расширения (т-ра 20° С) 27,56 х 10-6 град; удельная теплопроводность (т-ра 18° С) 0,083 кал/см х сек х град.
Теплоемкость (т-ра 0—100° С) 0,0306 кал/г х град; удельное электрическое сопротивление 20,68-10-6 ом-см.
Вязкость при т-ре 340° С равна 0,0189 nз, при т-ре 470° С составляет 0,0144 пз. Т-ра перехода в сверхпроводящее состояние 7,17 К. Свинец мягок и пластичен.
Модуль норм, упругости 1700 кгс/мм2; предел прочности на растяжение 1,2—1,3 кгс/мм2;
относительное удлинение 55%; НВ = 3—4.
Химические свойства
На воздухе свинец покрывается окисной пленкой, предохраняющей металл от дальнейшего окисления.
При нагревании расплавленного свинца на воздухе образуется окись РbО.
При медленном нагревании на воздухе РbО превращается в Рb3О4 красного цвета.
Разбавленные соляная и серная к-ты почти не действуют на металл. Свинец легко растворяется в азотной к-те, образуя нитрат.
При доступе воздуха свинец растворяется в уксусной к-те с образованием ацетата. Растворяется свинец в щелочах.
Свинец сплавляется со многими металлами, образуя свинца сплавы и интерметаллические соединения.
С железом не реагирует в жидком и твердом состоянии.
При нагревании непосредственно уединяется со многими неметаллами, в частности со всеми галогенами, с серой, селеном и теллуром. с. и его соединения ядовиты.
Предельно допустимая концентрация в воздухе 0,01 мг/м3.
Находится в одной группе с другими элементами, но валентность свинца является ключевым свойством, отличающим его от многих других элементов.
Причина валентности кроется в его атомарном строении. Чтобы увидеть это наглядно, обратите внимание на электронную формулу атома свинца.
Изотопы
Природный свинец состоит из стабильных изотопов 204Рb (1,4%), 206Рb (25,2%), 207Рb (21,7%) и 208Рb (51,7%).
А также следов пяти короткоживущих радиоизотопов.
Большое количество изотопов согласуется с тем, что свинец имеет четный атомный номер.
Модель ядерной оболочки соответствующим образом предсказывает чрезвычайно стабильное ядро свинца, поскольку оно содержит магическое число протонов (82).
Свинец-208 содержит 126 нейтронов, что является еще одним особым числом, которое может объяснить, почему он настолько стабилен.
Получение
Свинец получают из сульфидных концентратов, к-рые подвергают агломерирующему обжигу с последующей плавкой шихты в шахтной печи.
Качественная реакция на свинец нужна чтобы с точность определить его состав, для этого применяют неорганические и органические вещества.
Осн. продуктом плавки является черновой свинец (веркблей), содержащий 97 — 99% осн. металла и 3— 1% примесей (меди, сурьмы, олова, серебра, висмута и др.).
Распространены методы пирометаллургического и гидро-электролитического рафинирования веркблея.
Разработаны также способы рафинирования чернового свинца и разделения его сплавов электролизом ионных расплавов.
Для получения особо чистого металла применяют методы амальгамной металлургии, зонной перекристаллизации и др.
Свинец весьма легко поддается ковке и прокатывается в листы любой толщины. Свинцовую стружку можно спрессовать в монолитную массу при давлении 2 тс/см2.
Свинцовую проволоку получают, продавливая через фильеру твердый металл.
Кислород, азот, сернистый газ, водород, окись углерода, углекислый газ и углеводороды не растворяются ни в жидком, ни в твердом металлическом свинце.
Применение
Свинец применяют для облицовки (футеровки) химической аппаратуры, в электролизных ваннах металлургических заводов.
Он предохраняет от коррозии телеграфные и электр. провода, прокладываемые под землей или под водой (см. Коррозия металлов).
Большое количество свинец расходуется на производство аккумуляторов. На его основе изготовляют легкоплавкие, типографские и антифрикционные сплавы.
Некоторое количество свинца из-за способности поглощать радиоактивное излучение применяют в рентгенотехнике и ядерной технике.
Свинец используют в огнестрельном оружии, в полупроводниковой технике. Особо чистый металл идет на изготовление термоэлектрогенераторов, в к-рых осуществляется прямое превращение тепловой энергии в электрическую.
Эффективными материалами для изготовления термоэлектрогенераторов служат теллурид и селенид свинца.
Сплав меди со свинцом используют в сверхпроводниковой технике. Соединения свинец применяют в произ-ве красок, стекла, для очистки нефти.
Углекислую соль свинца 2PbCO3 · Рb(OН)2 используют для приготовления свинцовых белил; соединение Рb3O4 — для получения краски ярко-красного цвета.
Тетра-этилсвинец (С2Н5)4Рb — самый распространенный антидетонатор; азид свинца PbN6 — инициирующее вещество.
Окись РbО применяют в произ-ве легкоплавких, сильно преломляющих свет стекол, эмалей.
Существует только одно известное кристаллическое изменение с плотно упакованной металлической решеткой.
Пластичность, простота сварки, низкая температура плавления, высокая плотность и способность поглощать гамма- и рентгеновское излучение — все это свойства свинца, которые дополняют элементарное применение свинца.
Для элементарного серебра и золота расплавленный свинец является отличным растворителем и собирателем.
Низкая прочность свинца на растяжение и усталость, а также его склонность к растеканию даже при незначительной нагрузке ограничивают применение свинца в конструкции.
Когда свинец свеже срезан, он быстро окисляется, образуя тускло-серое покрытие, которое защищает металл от дальнейшей коррозии.
Это покрытие когда-то считалось субоксидом свинца (Pb2О), но теперь известно, что оно представляет собой смесь свинца и монооксида свинца (PbO).
Аналогичным образом, несмотря на то, что свинец растворим в разбавленной азотной кислоте, соляная или серная кислоты воздействуют на него только поверхностно из-за образования нерастворимых хлоридных (PbCl2) или сульфатных (PbSO4) покрытий.
А также в качестве облицовки водопроводных труб, трубопроводов и конструкций для транспортировки и переработки агрессивных веществ.
Из-за своей химической стойкости свинец обычно используется в кровельных покрытиях, в качестве покрытий для подземных или подводных электрических проводов.
Хотя ионы водорода могут окислять элементарный свинец до иона Pb2+, свинец устойчив ко многим кислотам из-за нерастворимости большинства соединений Pb2+.
Образование растворимых форм свинца в степени окисления +2 облегчает окисление в щелочных условиях.
В кислом растворе оксид свинца (PbO2, со свинцом в качестве иона Pb4+) является одним из наиболее сильных окислителей, хотя в щелочном растворе он очень слаб.
Легкости окисления свинца способствует образование комплексов. Водные растворы, содержащие гексафтористый силикат свинца.
А гексафторикремниевая кислота лучше всего подходит для электроосаждения свинца.
Пожароопасность
Свинец — Pb, голубовато — серый металл, горючее вещество. Ат. масса 207,2 ; температура плавления 327,4°C; температура кипения 1745°C.
При дисперсности образца 74 мкм тем. самовоспл, аэрогеля 270°C , аэровзвеси 580 °C ; макс. давл. взрыва 20 кПа ; макс. скорость нарастания давл. 700 кПа /с ; МВСК 10% (об).
Свинца сульфат, трудно горючее вещество, не склонен к самовозгоранию. Мол. масса 239,25; плотность 7100 кг /м3; температура плавления 1100°C. Дисперсность образца 250 мкм. Температура самовоспламенения аэрогеля 780 °C.
Плюмбум или свинец
Свинец — голубовато серый, мягкий, пластичный металл, легко режется ножом, имеет плотность 11,34 г/см³ и температурой плавления 327,5.
Тепло — и электропроводность свинца низкая. На воздухе он покрывается защитной оксидной плёнкой и тускнеет образуя PbO:
Pb + O2 = PbO
Также оксид свинца образуется при накаливании его на воздухе, а при большом доступе воздуха и не очень высокой температуре переходит в Pb3O4 (свинцовый сурик).
В присутствии влаги взаимодействует с кислородом воздуха по реакции:
2Pb+ O2 + 2H2O + 2Pb(OH)2
При повышенной температуре свинец преимущественно находится в соединении со степенью окисления 2+.
Отрицательную степень окисления проявляет только в соединении с некоторыми более электро положительными металлами, например с магнием (плюмбид Mg2Pb).
С водородом свинец непосредственно не взаимодействует, но его соединения получают косвенно:
Mg2Pb + 4HCl = 2MgCl2 + PbH4
При этом образуется неустойчивый, ядовитый газ плюмбан PbH4
Свинец практически не растворяется в соляной и разбавленной серной кислоте , так как покрывается нерастворимой плёнкой солей PbCl2 и PbSO4:
Pb + 2HCl = PbCl2 + H2
Pb + H2SO4 = PbSO4 + H2
Только при действии концентрированной серной кислоты образуется растворимая кислая соль и свинец начинает растворятся Pb(HSO4)2.
При взаимодействии с концентрированной и разбавленной азотной кислотой метал образует нитрат свинца Pb(NO3)2:
Pb + HNO3 = Pb(NO3)2 + NO + H2O
Для свинца более характерны соединения со степенью окисления 2+.
Окисление соединения свинца (II) до соединения свинца (IV) происходит лишь при действии сильных кислот:
Pb(CH3COO)2 + CaOCl2 + H2O = Pb2 + 2CH3COOH + CaCl2
Соединения свинца (IV) — сильные окислители, например, при кипячении с 30% серной кислотой диоксид свинца окисляет марганец с (II) до (VII) :
5PbO2 + 2MnSO4 + 3H2SO4 = 5PbSO4 + 2HMnO4 + 2H2O
Факты о свинце
Рассмотрим некоторые ключевые факты о свинце (Pb).
- Металлический элемент токсичен для человека и может поражать жизненно важные внутренние органы, вызывая в ряде случаев отравление свинцом.
- Сообщается, что металл препятствует росту органов и мозга в раннем детстве.
- Свинец — один из немногих элементов, которые были известны людям с незапамятных времен; в результате он так и не был должным образом обнаружен.
Алхимики считали свинец одним из древнейших металлов, поэтому использовали в алхимических реакциях в результате которого должно было получиться (золото).
Часто задаваемые вопросы и ответы
Обсудите соединения свинца?
Ответ: Степени окисления свинца равны +2 и +4. Среди нескольких важных соединений свинца — монооксид свинца, PbO.
Где свинец находится в состоянии +2; диоксид свинца, PbO2, где свинец находится в состоянии +4; и тетраоксид трисвинца, Pb3O4. Монооксид свинца делится на два типа: глет и массикоты.
Глет, также известный как альфа-монооксид свинца, представляет собой красновато-желтое твердое вещество с тетрагональной кристаллической структурой, стабильное при температуре ниже 488 ° C (910 ° F).
Желтый твердый массикот, также известный как бета-монооксид свинца, имеет орторомбическую кристаллическую структуру и стабилен при температуре выше 488 градусов Цельсия.
Объясните воздействие свинца на окружающую среду?
Ответ: Свинец и его продукты загрязнили почвы и реки Земли в результате их добычи, производства, использования и утилизации.
Промышленная революция и эпоха этилированного бензина во второй половине двадцатого века привели к самым высоким уровням выбросов свинца в атмосферу.
Природные источники (т.е. Концентрации природного свинца), промышленное производство, сжигание и переработка, а также мобилизация ранее захороненного свинца — все это источники выбросов свинца.
В постиндустриальных и городских районах в почвах и отложениях сохраняются повышенные концентрации свинца.
Промышленные выбросы, в том числе в результате сжигания угля, продолжаются во многих частях мира, особенно в развивающихся странах.
Литература
Основы металлургии, т. 2. М., Лоскутов Ф. М. Металлургия свинца. М., 1965; Некрасов Б. В. Курс общей химии. Автоматная латунь. Свинцевание. Свинцовистая бронза и баббит. Свинец в науке.
Часто задаваемые вопросы:
Самая стабильная и распространённая валентность свинца — +2.
Практически никогда не встречается в природе в чистом (самородном) виде.
Он является достаточно реактивным металлом и почти всегда находится в виде соединений, чаще всего — в свинцовых рудах.
Да очень опасен как для человека, так и для окружающей среды.
Он является токсичным тяжёлым металлом, который накапливается в организме и не выводится из него, вызывая серьёзные проблемы со здоровьем.


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.