Водород это химический элемент, простое вещество, один из самых распространенных элементов на земле и в космосе.
Водород имеет формулу Н2. Может быть получен в газообразном, жидком и твердом состоянии. В твердом состоянии проявляет металлические свойства, например проводник электрического тока.
По химическим свойствам он ближе к щелочным металлам, но по некоторым важным свойствам сходен с галогенами.

Что такое водород
(Hydrogenium — от греческого — вода и — рождаю ) Н — химический элемент, первого периода периодической таблицы химических элементов, первый в периодической системе элементов; ат. м. 1,0079.
В обычных условиях газ без цвета, запаха и вкуса. Проявляет различные степени окисления образуя ковалентные связи (Н2, НСl, органические соединения).
Выступая в виде положительно заряженного протона в к-тах, в виде отрицательно заряженного Н⁻ в солеобразных гидридах и участвуя в металлической связи в гидридах переходных металлов.
Водород — самый распространенный элемент вселенной, например атмосфера Солнца содержит 84% водорода. Земная кора на 1,0% по массе и на 16 ат.% состоит из В., гл. обр. в виде воды.
Почти все органические вещества содержат водород он встречается в вулканических и др. природных газах.
В обычных условиях молекула водорода состоит из двух атомов, связанных ковалентной связью.
При высоких т-рах молекулярный водород диссоциирует на атомы (степень диссоциации при т-ре 2500° С равна 0,0013, при т-ре 5000° С составляет 0,95).
Молекулярный водород — легчайший газ (в 14,32 раза легче воздуха); плотность его (т-ра 0° С, давление 1 am) 0,089870 г/л; tпл — 259,1° С; tкип -252,6° С.
Критическая точка: т-ра — 239° С, давление 12,8 am, критическая плотность 0,031 г/см³.
Температурный коэффициент объемного расширения (в интервале температура 0—100° С, давление 1 am) 0,003662.
Из всех газов обладает наибольшей теплопроводностью, равной (т-ра 0° С) 0,000412 кал/см . сек X град.
Теплоемкость (в интервале т-р 12—198° С) при пост, давлении 3,394 кал/г — град.
Изотопы
Природный водород состоит из смеси изотопов; легкого водорода, или протия ¹Н (99,98%) и тяжелого водорода (²Н), или дейтерия D (0,02%) с массовыми числами соответственно 1 и 2.
В небольших количествах существует в природе и получен искусственно бета-радиоактивный изотоп водорода (³Н), или тритий Т с массовым числом 3, период полураспада к-рого 12,262 года.
Его изотопы сильно отличаются по своим св-вам вследствие большого различия масс.
Протий и дейтерий стабильны, тритий — радиоактивен. В природных соединениях дейтерий и протий в среднем содержатся в отношении 1 :6800 (по числу атомов).
Тритий находится в природе в ничтожно малых количествах.
Ядро атома водорода 1Н содержит один протон. Ядра дейтерия и трития включают кроме протона соответственно один и два нейтрона.
Молекула водорода состоит из двух атомов. Приведем некоторые свойства, характеризующие атом и молекулу водорода:
- Энергия ионизации атома, эВ 13,60
- Сродство атома к электрону, эВ 0,75
- Относительная электроотрицательность водорода ≈ 2,20.
- Радиус атома, нм 0,046
- Межъядерное расстояние в молекуле, нм 0,0741
- Стандартная энтальпия диссоциации молекул 436,1 при 25 °С, кДж/моль
История
Водород (Hydrogenium) был открыт в первой половине XVI века немецким врачом и естествоиспытателем Парацельсом.
Впервые водород выделил англ. физик и химик Г. Кавендиш (Англия) в 1766, назвав его «горючим воздухом», установил его свойства и указал отличия от других газов.
Первый получил водород из воды французский химик А, Лавуазье и доказал, что вода есть химическое соединение водорода с кислородом (1783 г.).
В 1787 определил «горючий воздух» как новый хим. элемент и дал ему современное название.
Водород в природе
Водород в свободном состоянии встречается на Земле лишь в незначительных количествах. Иногда он выделяется вместе с другими газами при вулканических извержениях, а также из буровых скважин при добывании нефти.
Но в виде соединений водород весьма распространен. Это видно уже из того, что он составляет девятую часть массы воды.
Водород входит в состав всех растительных и животных организмов, нефти, каменного и бурого углей, природных газов и ряда минералов.
На долю водорода из всей массы земной коры, считая воду и воздух, приходится около 1%. Однако при пересчете на проценты от общего числа атомов содержание водорода в земной коре равно 17%.
Такое большое различие между величинами, выражающими содержание водорода в процентах от общего числа атомов и в процентах по массе, объясняется тем, что атомы водорода намного легче атомов других элементов, в частности наиболее распространенных в земной коре кислорода и кремния.
Водород — самый распространенный элемент космоса. На его долю приходится около половины массы Солнца и большинства, друг звезд.
Он содержится в газовых туманностях, в межзвездном газе, входит в состав звезд. В недрах звезд происходит превращение ядер атомов водорода в ядра атомов гелия.
Этот процесс протекает с выделением энергии, для многих звезд, в том числе для Солнца, он служит главным источником энергии.
Скорость процесса, т. е. количество ядер водорода, превращающихся в ядра гелия в одном кубическом метре за одну секунду, мала.
Поэтому и количество энергии, выделяющейся за единицу времени в единице объема, мало.
Однако, вследствие огромности массы Солнца, общее количество энергии, генерируемой и излучаемой Солнцем, очень велико.
Оно соответствует уменьшению массы Солнца приблизительно на 4 млн. т в секунду.
Физические свойства водорода
Водород при нормальных условиях представляет собой двухатомный газ. Его температура плавления равна 15,9° К, а температура кипения при нормальных условиях 20,4° К.
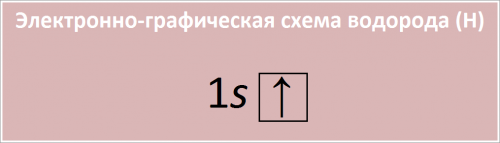
Полная электронная конфигурация водорода: 1s1
При более низкой температуре, чем водород, кипит только гелий. Некоторые физические свойства водорода приведены в таблице.
Таблица свойств водорода
| Свойство | Водород |
| Порядковый номер | 1 |
| Атомный вес | 1,008 |
| Молекулярная формула | Н2 |
| Температура кипения °К | 20,4 |
| Температура кипения °С | —252,8 |
| Температура плавления °К | 14,0 |
| Температура плавления °С | —259,2 |
| Атомный объем в твердом состоянии, см3/моль атомов | 13,1 |
По физическим свойствам водород напоминает галогены. Водород, подобно галогенам,— двухатомный газ, а не металл, чем он и отличается от щелочных металлов.
Он имеет очень низкую температуру плавления и узкий интервал температур, в котором устойчив в жидком состояния.
Однако, поскольку взаимосвязь между элементами одной группы основывается на всех их свойствах, прежде чем охарактеризовать этот единственный в своем роде элемент, необходимо изучить все его реакции.
Химические свойства
По своим химическим свойствам водород является довольно активным веществом. При нагревании он легко взаимодействует с многими неметаллами : бромом , кислородом , серой и т.д .
С фтором реакция идёт со взрывом уже при комнатной температуре :
H2 + F2 = 2HF + 535 кДж ( 128 ккал )
Восстановительные свойства водорода проявляются при выделении металлов из их солей :
CuO + H2 = Cu + H2O
При взаимодействии с активными металлами , такие как щелочно земельные , водород выступает как окислитель :
2Na + H2 = 2NaH
В гидридах щелочных и щелочноземельных металлов водород находится в степени окисления 1-.
Гидриды по своим свойствам напоминают галогениды соответствующих металлов.
При взаимодействии с водой они образуют водород :
NaH + H2O = NaOH + H2
Гидриды для большинства химических элементов , по своим свойствам и строению могут быть разделены на четыре группы :
1. Газообразные или легко летучие [(BH3)2 , NH3 , CH4]
2 . Солеобразные [NaH , CaH ]
3 . Полимерные [ ( BeH2 )x, (AlH3)x]
4 . Метало-образные.
Эти соединения не имеют постоянного состава и могут рассматриваться как твёрдые растворы водорода в металлах (водород растворённый в палладии).
Химическая активность водорода особенно высока в момент выделения. Это объясняется тем , что в начальный момент, например при взаимодействия цинка с кислородом, водород находится в виде атома.
А в реакциях с атомами отпадает необходимость затраты энергии на разрыв связи в молекуле H2.
В отличие от молекулярного , атомарный водород уже при комнатной температуре восстанавливает оксиды металлов , соединяется с молекулярным кислородом , серой , фосфором и мышьяком
Одна из наиболее характерных реакций как щелочных металлов, так и галогенов — это их реакция друг с другом.
В качестве такого примера реакция между натрием и хлором с образованием хлористого натрия.
Хлористый натрий
Хлористый натрий — твердое ионное вещество, которое при растворении в воде образует положительно заряженные ионы Na+ и отрицательно заряженные ионы Сl—;
Na (тв) + 1/2 Cl2 (г) → NaCl (тв) (27)
NaCl (тв) + Н2O → Na+ (водн) + Сl— (водн) (28)
Может ли водород реагировать, как натрий или хлор в реакции (27)?
Эксперименты показывают, что водород может вступать в реакцию и с натрием, и с хлором:
Na (тв) + 1/2 Н2 (г) → NaH (тв) (29)
1/2 Н2 (г) + 1/2 Сl2 (г) → HCl (г) (30)
НСl (г) +Н2O → Н+ (водн) + Cl— (водн) (31)
Гидрид натрия
Гидрид натрия, образующийся по реакции (29),— кристаллическое соединение, по физическим свойствам напоминающее хлористый натрий.
Однако химические свойства этих соединений совсем разные. Натрий легко сгорает в хлоре, тогда как с водородом он реагирует лишь при температуре около 300° С.
Хлористый натрий — устойчивое вещество, образующее при растворении в воде ионы Na— и Сl—.
Гидриды щелочных металлов горят на воздухе, а некоторые из них воспламеняются самопроизвольно.
Гидриды щелочных металлов энергично взаимодействуют с водой с выделением водорода:
NaH (тв) + Н2O→ Н2 (г) + Na+ (водн) + ОН— (водн) (32)
Таким образом, в реакции (29) водород реагирует с металлическим натрием, подобно галогену [как в реакции (27)].
Но продукт реакции — гидрид натрия — сильно отличается по своим химическим свойствам от хлористого натрия.
Реакция (30) показывает, что водород реагирует так же, как щелочной металл. Хотя продукт реакции—хлористый водород — не является твердым веществом с ионными связями, при растворении в воде он образует гидратированные ионы.
Образование гидратированных ионов Н+ и Сl—совершенно аналогично образованию гидратированных ионов Na+ и Сl—при растворении в воде хлористого натрия.
Способность водорода образовывать в воде положительно заряженные ионы Н+ (существование в растворе отрицательно заряженных ионов Н— не доказано) является одним из наиболее резких различий между водородом и галогенами.
По совокупности всех химических свойств водород следует рассматривать отдельно как самостоятельную химическую группу.
Водород по некоторым важным свойствам сходен с галогенами — как мы знаем, он является устойчивым двухатомным газом, но по химическим свойствам он ближе к щелочным металлам.
Поэтому водород обычно располагают в левой части периодической таблицы, как и щелочные металлы, но отдельно от них, чтобы подчеркнуть его особые свойства.
Гидриды
Соединения водорода с металлами называются гидридами. Гидриды щелочных и щелочноземельных металлов представляют собой соли, т. е. химическая связь между металлом и водородом в них ионная.
Это кристаллы белого цвета. Все они нестойки и при нагревании разлагаются на металл и водород.
При действии на них воды протекает окислительно-восстановительная реакция, в которой гидрид-ион Н— выступает в качестве восстановителя, а водород воды — в качестве окислителя:
Н-1 = Н0 + е—; Н2О + е— = Н0 + ОН—
В результате реакции образуются водород и основание. Например, гидрид кальция реагирует с водой согласно уравнению:
СаН2 + 2Н2О = 2Н2↑ + Са(ОН)2
Эта реакция используется для определения следов влаги и для их удаления.
Кроме солеобразных известны металлообразные и полимерные гидриды. По характеру химической связи в металлообразных гидридах последние близки к металлам.
Они обладают значительной электрической проводимостью и металлическим блеском, но очень хрупки, к ним относятся гидриды титана, ванадия, хрома.
В полимерных гидридах (например, в гидридах цинка и алюминия) атомы металла связаны друг с другом водородными «мостиками», подобно тому, как это имеет место в молекулах бороводородов.
Получение водорода
В лабораториях водород получают действием кислоты ( разбавленной серной кислотой или соляной кислотой ) на цинк :
Zn + H2SO4 = ZnSO4 + H2↑
Технический способ получения водорода основаны на более дешёвом сырье , в частности его получают при взаимодействии водяного пара с раскалённым углём (углерод):
C + H2O = CO + H↑
Полученный таким образом смесь называют водяным газом . В присутствии катализаторов ( Fe2O3 ) при 500°C оксид углерода ( II ) может быть превращён в CO2 по реакции :
CO + H2O = CO2 + H2↑
Промышленные способы получения водорода — это переработка коксовых газов и газов крекинга нефти, природных газов, гл. обр. метана, на основе реакций :
СН4 + Н2O ↔ СО + 3Н2
версии водяного пара.
Чистый водород получают электролизом водных растворов щелочей.
В промышленности водород получают главным образом из природного газа. Этот газ, состоящий в основном из метана, смешивают с водяным паром и с кислородом.
При нагревании смеси газов до 800—900 °С в присутствии катализатора происходит реакция, которую схематически можно изобразить уравнением:
2СН4 + О2 + 2Н2О = 2СО2 + 6Н2
Полученную смесь газов разделяют. Водород очищают и либо используют на месте получения, либо транспортируют в стальных баллонах под повышенным давлением.
Получение водорода из растворов щелочей

В лабораториях водород получают большей частью электролизом водных растворов NaOH или КОН.
Концентрация этих растворов выбирается такой, которая отвечает их максимальной электрической проводимости (25% Для NaOH и 34% для КОН). Электроды обычно изготовляют из листового никеля.
Этот металл не подвергается коррозии в растворах щелочей, даже будучи анодом. В случае надобности получающийся водород очищают от паров воды и от следов кислорода.
Из других лабораторных методов наиболее распространен метод выделения водорода из растворов серной или соляной кислот действием на них цинка. Реакцию обычно проводят в аппарате Киппа (рис.).
Применение
Водород применяют в хим. пром-сти, гл. обр. для синтеза аммиака; в произ-ве метилового и др. спиртов, синтетического бензина и др. продуктов на основе взаимодействия водорода с окисью углерода.
Его используют также для гидрогенизации твердого и жидкого топлива, жиров, для синтеза соляной к-ты, при сварке и резании металлов кислородно-водородным пламенем, для восстановления руд.
Дейтерий и тритий нашли применение в атомной энергетике.
Главное применение водорода находит в химической промышленности для синтеза хлороводорода, в больших количествах используют в производстве аммиака.
Аммиак в свою очередь на производство азотной кислоты и азотных удобрений, для получения метилового спирта и других органических соединений.
- Путём гидрогенизации (присоединения водорода) получают твёрдое топливо топливо, а также тяжёлое топливо (тяжёлые остатки от переработки нефти и каменной смолы) в лёгкое моторное топливо.
- Гидрогенизация жидких растительных жиров (солнечного, хлопкового, соевого) получают твердые жиры , используемые для выработки маргарина, в мыловарении и т.д.
- В процессе гидрогенизации жиров образуется предельные глицериды с более высокой температурой плавления, чем исходные жиры.
- В соединении водорода с кислородом (вода) используется как важнейшая часть в жизнедеятельности всех организмов, деревьев и растений.
- Он используется для гидрогенизации жиров, угля и нефти.
- При гидрогенизации угля и нефти бедные водородом низкосортные виды топлива превращаются в высококачественные.
- Водород используют для охлаждения мощных генераторов электрического тока, а его изотопы находят применение в атомной энергетике.
Применение в металлургии
При высокой температуре водород может отнимать кислород от многих соединений, в том числе от большинства оксидов металлов.
Например, если пропускать водород над накаленным оксидом меди, то происходит восстановление меди:
СuО + Н2 = Сu + Н2О
Поэтому водород применяют в металлургии для восстановления некоторых цветных металлов из их оксидов.
Жидкий водород
Жидкий водород это прозрачная, бесцветная, не проводящая электр. тока жидкость, поверхностное натяжение к-рой в 35 раз меньше, чем у воды.
Плотность жидкого водорода при т-ре кипения 0,0708 г/см³. Теплота испарения (т-ра 20,4 К )108—114 кал/г.
При т-ре 1,65 К твердый водород имеет гексагональную решетку с периодами а = 3,75 А, с =6,13 А, с/а = 1,633. Рентгеновская плотность 0,088 г/см³. Теплота плавления ~ 14 кал/г.
Сжимаемость твердого водорода наибольшая по сравнению со сжимаемостью твердых тел и составляет (т-ра 4,2 К, давление ~ 10000 аm ) 4,8 . 10-4 см²/кг.
Водород плохо растворяется в воде (при т-ре 20° С в 100 объемах воды растворяется 1,82, при т-ре 80° С — 0,85 объема). Еще меньше растворимость его в органических растворителях.
В небольших количествах растворяется во всех расплавленных металлах, во многих (никеле, платине и др.) хорошо, особенно в палладии (850 объемов на 1 объем палладия).
При высоких т-рах растворяется в огнеупорных материалах, в кварце (при т-ре 690° С и давлении 788 мм рт. ст. содержится 6,0 X 10⁻⁸ г/см² В.).
Водород — один из самых реакционно способных хим. элементов, непосредственно взаимодействует со многими металлами и неметаллами, входит в состав мн. неорганических и почти всех органических соединений.
В обычных условиях молекулярный водород малоактивен.
При нагревании вступает в реакцию со многими химическими элементами:
- С кислородом образует воду (пределы взрывоопасности от 4 до 94% В.),
- С фтором реакция идет со взрывом, с хлором и бромом — при освещении, с йодом — только при нагревании.
- С азотом взаимодействует (с образованием аммиака) при наличии катализатора, под давлением и при высокой т-ре.
- При нагревании водород энергично реагирует с серой, значительно труднее — с селеном и теллуром.
- Непосредственно реагирует с некоторыми металлами (щелочными, щелочноземельными и др.), образуя гидриды (NaH, СаН2, ТiH2 и т. д.).
Водород в таблице
Помещение водорода в периодической системе элементов не однозначно.
Раньше его помещали в главную подгруппу I группы периодической системы, а в настоящее время его располагают в начале подгруппы галогенов.
Заметим что нахождение водорода в современных таблицах Менделеева могут быть как в I так и VII. Соответственно обозначаясь Н и (Н).
В пользу помещения водорода в начало подгруппы галогенов :
- Водород , как и щелочные металлы , проявляет в большинстве соединений степень окисления водорода 1+ и валентность I.
- Подобно щелочным металлам, водород обладает ярко выраженными восстановительными свойствами.
- Для водорода и металлов, в том числе и щелочных, характерна реакция взаимного вытеснения.
Сходство водорода с галогенами
- Подобно атомам галогенов, атом водорода может присоединять электрон с образованием иона водорода, который является изоэлектронным ближайшему благородному газу.
- Как и лёгкие галогены, простое вещество — водород — газообразно при обычных условиях и молекула состоит из двух атомов.
- Водород в соединениях замещается галогенами . Многочисленные примеры в органической химии.
- Потенциал ионизации водорода соизмерим с потенциалом ионизации галогенов. Так как, потенциал ионизации атома водорода равен 13,6 эВ, атома фтора 17,4 эВ, а атом лития всего 5,6 эВ .
Водород — один из наиболее распространённых элементов на Земле. Его общее содержание в земной коре составляет ~ 1% ( масс . ).
При пересчёте на атомарные количество оказывается, что из каждых 100 атомов земной коры на долю водорода приходится 17.
Дейтерий и тритий
Кроме легкого водорода H известны два других его изотопа, дейтерий и тритий.
Дейтерий играет важную роль в атомной технике , тяжёлую воду D2O используют как замедлитель нейтронов в ядерных реакторах.
Тритий является радиоактивным изотопом водорода , в результате распада ядро трития испускает β — частицу и превращается в ядро атома гелия :
T > β + He
В результате замены в соединениях легкого водорода на тритий получают «меченые» препараты, которые широко использовались в химических исследованиях.
Свойства водорода
Водород — бесцветный газ, не имеющий запаха. При температуре ниже —240 С (критическая температура водорода) он под давлением сжижается; температура кипения жидкого водорода — 252,8 °С (при нормальном атмосферном давлении).
Если быстро испарять эту жидкость, то получается твердый водород в виде прозрачных кристаллов, плавящихся при —259,2 °С.
Водород — самый легкий из всех газов, он в 14,5 раза легче воздуха; масса 1 л водорода при нормальных условиях равна 0,09 г.
В воде водород растворим очень мало, но в некоторых металлах, например в никеле, палладии, платине, растворяется в значительных количествах.
С растворимостью водорода в металлах связана его способность диффундировать через металлы.
Кроме того, будучи самым легким газом, водород обладает наибольшей скоростью диффузии.
Его молекулы быстрее молекул всех других газов распространяются в среде другого вещества и проходят через разного рода перегородки.
Особенно велика его способность к диффузии при повышенном давлении и высоких температурах. Поэтому работа с водородом в таких условиях сопряжена со значительными трудностями.
Диффузия водорода в сталь при высоких температурах может вызвать водородную коррозию стали.
Этот совершенно особый вид коррозии состоит в том, что водород взаимодействует с имеющимся в стали углеродом, превращая его в углеводороды (обычно в метан), что приводит к резкому ухудшению свойств стали.
Химические свойства водорода в значительной степени определяются способностью его атомов отдавать единственный имеющийся у них электрон и превращаться в положительно заряженные ионы.
При этом проявляется особенность атома водорода, отличающая его от атомов всех других элементов: отсутствие промежуточных электронов между валентным электроном и ядром.
Йон водорода, образующийся в результате потери атомом водорода электрона, представляет собой протон, размер которого на несколько порядков меньше, размера катионов всех других элементов.
Поэтому поляризующее действие протона очень велико, вследствие чего водород не способен образовывать ионных соединений, в которых он выступал бы в качестве катиона.
Его соединения даже с наиболее активными неметаллами, например с фтором, представляют собой вещества с полярной ковалентной связью.
Атом водорода способен не только отдавать, но и присоединять один электрон. При этом образуется отрицательно заряженный ион водорода с электронной оболочкой атома гелия.
В виде таких ионов водород находится в соединениях с некоторыми активными металлами.
Водород имеет двойственную химическую природу, проявляя как окислительную, так и восстановительную способность.
Почему водород находиться первой и седьмой группе
В большинстве реакций он выступает в качестве восстановителя, образуя соединения, в которых степень его окисленности равна + 1.
Но в реакциях с активными металлами он выступает в качестве окислителя: степень окисленности его в соединениях с металлами равна —1.
Таким образом, отдавая один электрон, водород проявляет сходство с металлами первой группы периодической системы, а присоединяя электрон, — с неметаллами седьмой группы.
Поэтому водород в периодической системе обычно помещают либо в первой группе и в то же время в скобках в седьмой, либо в седьмой группе и в скобках в первой.
Водород и кислород
Если к струе водорода, выходящей из какого-нибудь узкого отверстия, поднести зажженную спичку, то водород загорается и горит несветящимся пламенем, образуя воду:
2Н2 + О2 = 2Н2О
При поджигании смеси 2 объемов водорода с 1 объемом кислорода соединение газов происходит почти мгновенно во всей массе смеси и сопровождается сильным взрывом.
Смесь водорода с кислородом называют гремучим газом.
Стандартная энтальпия этой реакции в расчете на 1 моль образующейся жидкой воды равна —285,8 кДж, а в расчете на 1 моль водяного пара —241,8 кДж.
Таким образом, при горении водорода выделяется большое количество теплоты. Температура водородного пламени может достигать 2800 °С.
Водородно-кислородным пламенем пользуются для сварки и резки металлов, для плавления тугоплавких металлов.
Почему водород с кислородом не реагирует при низких температурах
При низких температурах водород с кислородом практически не взаимодействуют. Если смешать оба газа и оставить смесь, то и через несколько лет в ней нельзя обнаружить даже признаков воды.
Если же смесь водорода с кислородом поместить в запаянный сосуд и держать в нем при 300 °С, то уже через несколько дней образуется немного воды.
При 500 °С водород полностью соединяется с кислородом за несколько часов, а при нагревании смеси до 700 °С происходит быстрый подъем температуры и реакция заканчивается практически мгновенно.
Поэтому, чтобы вызвать взрыв смеси, нужно нагреть ее хотя бы в одном месте до 700 °С.
Малая скорость взаимодействия водорода с кислородом при низких температурах обусловлена высокой энергией активации этой реакции.
Молекулы водорода и кислорода очень прочны; любое столкновение между ними при комнатной температуре оказывается неэффективным.
Лишь при повышенных температурах, когда кинетическая энергия сталкивающихся молекул делается большой, некоторые соударения молекул становятся эффективными и приводят к образованию активных центров.
Применение катализатора может сильно увеличить скорость взаимодействия водорода с кислородом.
Внесем, например, кусочек платинированного (т. е. покрытого мелко раздробленной платиной) асбеста в смесь водорода с кислородом.
Взаимодействие между газами настолько ускоряется, что через короткое время происходит взрыв.
Напомним, что реакция между водородом и кислородом является цепной и протекает по разветвленному механизму.
Атомарный водород
При высокой температуре молекулы водорода диссоциируют на атомы:
Н2 ⇄ 2Н
Осуществить эту реакцию можно, например, раскаляя током вольфрамовую проволочку в атмосфере сильно разреженного водорода.
Реакция обратима, и чем выше температура, тем сильнее равновесие сдвинуто вправо.
При 2000 °С степень диссоциации (т. е. доля молекул, подвергшихся диссоциации) составляет только 0,1%, при 3000°С —9%, при 4000°С — 62,5%, при 5000°С — 94,7% (все величины относятся к случаю, когда давление в системе равно нормальному атмосферному давлению).
Атомарный водород получается также при действии тихого электрического разряда на молекулярный водород, находящийся под давлением около 70 Па.
Образующиеся при этих условиях атомы водорода не сразу соединяются в молекулы, что дает возможность изучить их свойства.
При разложении водорода на атомы поглощается большое количество теплоты:
Н2 = 2Н — 436 кДж
Отсюда понятно, что атомы водорода должны быть гораздо активнее его молекул.
Чтобы молекулярный водород вступил в какую-либо реакцию, молекулы должны сперва распасться на атомы, для чего необходимо затратить большое количество энергии.
При реакциях же атомарного водорода такой затраты энергии не требуется.
Действительно, атомарный водород уже при комнатной температуре восстанавливает многие оксиды металлов, непосредственно соединяется с серой, азотом и фосфором; с кислородом он образует пероксид водорода.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.