Окислитель это химическое вещество, которое ведет себя в химических реакциях как окислитель, то есть окисляет его.
Примером окислителя можно считать кислород в химических реакциях, например горение водорода Н2 в кислороде О2, а так же галогены: фтор, хлор, йод, бром и много других.\
Что такое окислитель
Окислителями могут быть нейтральные атомы или положительно заряженные ионы.
Нейтральные атомы. Окислителями могут быть только те из нейтральных атомов, которые, принимая электроны, переходят в отрицательно заряженные ионы, т. е. только нейтральные атомы неметаллов.
Рис. Перекись водорода окислитель.
Самые сильные окислители — атомы галогенов, так как они могут принимать только один электрон. Самые слабые окислители— атомы неметаллов четвертой группы.
В группах (4 — 7) окислительные свойства падают с возрастанием величин радиусов нейтральных атомов.
Следовательно, из нейтральных атомов самый сильный окислитель — фтор, а самый слабый — свинец.
Неметаллы могут быть не только окислителями, т. е. принимать электроны, но и отдавать электроны, т. е. быть восстановителями.
Положительно заряженные ионы как металлов, так и неметаллов также могут быть окислителями, так как они принимают электроны от других атомов или ионов.
В процессе реакции они переходят:
а) В положительные ионы низшей зарядности,
б) В нейтральные атомы,
в) В отрицательно заряженные ионы.
Например:
а) Sn+4 + 2ē → Sn+2;
б) Cu+2 + 2ē → Cu;
в) N+5+8ē → N-3.
Чем больше энергии было затрачено на отрыв электронов, тем сильнее они будут притягиваться образовавшимися ионами.
Поэтому к сильным окислителям относятся, например, ионы „благородных» металлов, их ионизационные потенциалы довольно высокие:
Au — 9,18 V, Ag — 7,54 V, Pd — 8,3 V, Pt — 8,88 V.
Многозарядные положительные ионы обычно являются более сильными окислителями сравнительно с малозарядными ионами тех же атомов.
Так как на отрыв большего числа электронов у них затрачено большее количество энергии.
Так, N+5 более сильный окислитель, чем N+3, Fe+6 более сильный окислитель, чем Fe+8, и т. д.
Необходимо заметить, что, хотя такие многозарядные положительные ионы в растворе существуют только в виде сложных анионов типов ЭO‘3, ЭO»4, ЭO‘4 и др., это, однако, нисколько не понижает их окислительной способности. Они являются сильными окислителями.
К наиболее сильным окислителям принадлежат: фтор, озон, двуокись свинца, ионы «благородных» металлов и многовалентные положительные ионы.
Применяемые окислители в технике и лабораторной практике делятся на нейтральные, кислые и щелочные.
Нейтральные окислители
1. Кислород О2 применяется для интенсификации производственных процессов в металлургической и химической промышленности (например, в доменном процессе, в производстве серной и азотной кислоты и т. д.).
В нейтральной среде реакция окисления кислородом протекает по уравнению:
O2 + 2Н2O + 4ē ⇄ 4OН‘,
а в кислой среде:
O2 + 4H• + 4ē ⇄ 2Н2O
2. Озон О3 отличается от кислорода более сильной окислительной способностью: он многие красящие вещества обесцвечивает, металлы (за исключением Au, Pt и др.).
Окисляет, аммиак окисляет в азотистую и азотную кислоты, сернистые соединения — в сернокислые и т. д.
В нейтральной среде реакция окисления озоном протекает по уравнению:
O3 + H2O + ē → O2 + 2H‘,
в кислой среде:
O3 + 2Н• + 2ē → O2 + Н2O.
3. Электрический ток широко используется в технике не только как восстановитель, но и как окислитель для получения различных химически чистых веществ.
Кислые окислители
1. Хромовая и двухромовая кислоты известны только в растворе, поэтому вместо свободных кислот пользуются их устойчивыми солями (К2Сr2O7 и К2СrO4).
Которые и применяются в промышленности и лабораторной практике для окисления различных веществ.
Обычно пользуются для этой цели смесью бихроматов калия или натрия с серной кислотой (60 ч. К2Сr2O7 +80 ч. конц. H2SO4 + 270 ч. Н2O).
2. Азотная кислота HNO3 — один из сильнейших окислителей. Она окисляет очень многие металлы. Ею относительно легко окисляются и многие неметаллы.
Например: сера (при кипячении) до H2SO4, фосфор —до Р3РО4 углерод —до СО2 и т. д.
3. Азотистая кислота HNO2 хотя и является окислителем, но при взаимодействии с более сильными окислителями сама проявляет восстановительные свойства, окисляясь до азотной кислоты.
Азотистая кислота и её соли (KNО2 и NaNО2) применяются в качестве окислителей главным образом в производстве органических красителей.
4. Серная кислота H2SO4 концентрированная — сравнительно сильный окислитель, особенно при высокой температуре. Она окисляет С до СО2, S до SO2, HJ и НВr (частично) до свободных галогенов (J2 и Вr2).
Серная кислота окисляет также многие металлы: Cu, Ag, Hg и др. Однако такие металлы, как Au, Pt, Ru, Os и др., устойчивы по отношению к ней.
Проявляя окислительные свойства, H2SO4 обычно восстанавливается до SO2, с более сильными восстановителями— до S и даже до H2S.
Разбавленной серной кислотой окисляются только активные металлы, стоящие в ряду напряжений выше пары водорода.
5. Хлорноватая кислота — в растворе является энергичным окислителем. Так, например, 40% водный раствор её окисляет горючие вещества (например, бумагу и др.) с воспламенением.
Соли её, хлорноватокислые или хлораты, в растворе окислительных свойств не проявляют, но, будучи в кристаллическом состоянии при сплавлении, являются сильными окислителями.
Наиболее важной солью из них является хлорноватокислый калий (бертолетова соль).
6. Перекись водорода Н2O2, являясь сильным окислителем, используется в тех случаях, когда требуется окислить вещество, сравнительно легко разрушающееся от других окислителей.
В технике Н2O2 применяется для отбеливания тканей, слоновой кости, соломы, мехов, перьев и т. д.
Разрушая красящие вещества, перекись водорода почти не затрагивает отбеливаемого материала. В медицине Н2O2, сильно разбавленная, применяется для полоскания горла и промывки ран.
Она применяется также для обновления потускневших картин, написанных масляными красками.
В реакциях с более сильными окислителями Н2O2 сама проявляет восстановительные свойства.
Она способна также к реакциям самоокисления-самовосстановления.
7. Двуокись марганца MgO2 в кислой среде применяется при получении хлора из соляной кислоты, в стекольной промышленности.
Для окисления различных сернистых соединений и производных железа, при изготовлении гальванических элементов типа Лекланше и т. д.
8. Двуокись свинца PbO2 является исключительно сильным окислителем. Она широко применяется в работе свинцовых аккумуляторов.
Щелочные окислители
1. Марганцовокислый калий КМnO4 (перманганат калия)— сильный окислитель, применяется для окисления многих органических соединений.
Перманганат калия в кислой среде окисляет соли двухвалентного олова и железа в соли четырёх- и трёхвалентные.
Он также окисляет: сульфиты — в сульфаты, нитриты — в нитраты, йодистый калий — до свободного йода, соляную кислоту — до хлора, перекись водорода— до кислорода и т. д.
Характер восстановления КМnO4 зависит от среды, в которой протекает реакция.
2. Хлорная (или белильная) известь относится к числу наиболее сильных окислителей, широко применяется для отбелки тканей и бумаги, для дезинфекции и т. д.
В военное время хлорная известь используется для дегазации местности, заражённой отравляющим веществом.
3. Растворы гипохлорита калия и натрия
2KOH + Cl2 = KOCl + KCl + H2O
2NaOH + Cl2 = NaOCl + NaCl + H2O
применяются для отбелки тканей, главным образом хлопчатобумажных и льняных, а также бумаги.
Особое место занимают ионы так называемой промежуточной зарядности, которые в зависимости от условий реакции могут быть как окислителями, так и восстановителями.
Таковы, например:
S+4 в соединении Na2SO3; N+3 „ , KNO2; Мn+4 „ „ МnO2; Cl+1 „ „ NaOCl.
Следовательно, подразделение веществ на восстановители и окислители имеет до некоторой степени условный характер.
И преследует цель — указать на преобладание окислительных или восстановительных свойств у данного вещества в определённых условиях.
Статья на тему Окислитель

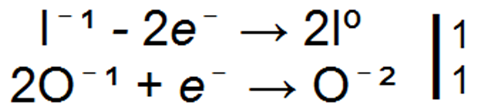
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.