(Natrium — от арабского натрун — сода ) , Na — химический элемент 1-й группы (устаревшая классификация: главной подгруппы первой группы, IA).
Атомный номер 11, атомная масса 22,98977.
Серебристо — белый мягкий металл. В соединениях проявляет степень окисления Na +1.
Металлический натрий впервые получил (1807) англ. химик и физик Г. Дэви электролизом влажного едкого натра.
Что такое натрий
Натрий широко распространен в природе (среди элементов, слагающих литосферу, занимает седьмое место).
Содержание его в земной коре 2,50%. В свободном состоянии в природе не встречается из-за большой химической активности.
Входит в состав 222 минералов.
Содержится в кислых изверженных (например, в гранитах до 2,77%) и в основных (в базальтах до 1,94%) породах.
Однако в осадочных породах (глинах, сланцах) и в почве содержание не превышает соответственно 0,66 и 0,63%.
Натрий содержится также в морской воде, минеральных источниках, каменном угле, живых организмах и растениях.
Важнейшие минералы, содержащие натрия:
Физические свойства
Натрий кристаллизуется в объемноцентрированной кубической решетке с периодом а = 4,2820А (т-ра 20° С).
Атомный радиус 1,89 А, ионный радиус Na+ равен 0,98 А. Плотность (т-ра 0° С) 0,9727 г/см3 , tпл 97,83° С; tкип 882,9° С.
Средний температурный коэфф. линейного расширения твердого Н (в интервале т-р 0—50° С) 7,21 • 10-5 град-1; коэфф. теплопроводности 0,317 кал/см X сек • град.
Теплоемкость 6,60 кал/г-моль • град; удельное электрическое сопротивление (т-ра 0 С) 4,288 • 10-6 ом • см.
Металлический натрий парамагнитен. Весьма пластичен, в холодном состоянии легко режется ножом, протягивается через фильеры, однако при сильном охлаждении становится хрупким.
Твердость по Моосу 0,4; давление истечения при комнатной т-ре 0,33 кгс/мм2; коэфф. сжимаемости при т-ре — 25° С равен 1,600 • 10-5аm -1.
Пары окрашены в пурпурно-красный цвет, напоминающий окраску разбавленного перманганата.
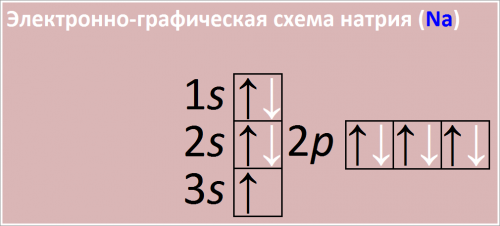
Электронная формула атома натрия:
1s2 2s2 2p6 3s1
Сокращенная электронная конфигурация Na:
[Ne] 3s1
Рис. Схема распределения электронов по атомным орбиталям в атоме натрия.
Химические свойства
Летучие соединения натрия окрашивает пламя горелки в характерные желтый цвет. Химическая активность очень высокая.
Металлический натрий на воздухе быстро окисляется, образуя гидроокись NaOH и карбонат NaCО3.
На свежем срезе образуется бикарбонат NaHCО3.
Взаимодействие его с водой происходит бурно с выделением теплоты:
2Na + 2H2O = 2NaOH + H2↑
Натрий непосредственно взаимодействует с кислородом, галогенами, серей и фосфором.
При 350°C натрий соединяется с водородом, образуя гидрид NaH, водород проявляет в нём отрицательную степень окисления — 1.
Но гидрид натрия нестоек и легко разлагается водой:
NaH + H2O = H2↑ + NaOH
Пероксид натрия Na2O2 получается при сгорании натрия в условиях избытка кислорода:
2Na + O2 = Na2O2
При взаимодействии пероксида натрия с оксидом углерода (IV) выделяется кислород:
2Na2O2 + 2CO2 = O2↑ + 2Na2CO3
Поэтому пероксид натрия используют для получения кислорода на подводных лодках, в изолирующих противогазах и т.п.
Под действием влаги пероксид натрия разлагается с выделением пероксида водорода:
Na2O2 + 2H2O = H2O2 + 2NaOH
перекись водорода обладая высокой окислительной активностью , отбеливает различные материалы.
Взаимодействие пероксида натрия с порошкообразным алюминием, железом, некоторыми органическими веществами (в присутствии влаги) сопровождается воспламенением и взрывом.
Оксид натрия Na2O получают сплавлением пероксида с металлическим натрием:
2Na + Na2O2 = 2Na2O
На воздухе можно нагревать до т-ры плавления (что невозможно для калия, рубидия и цезия).
С водородом при т-ре 200 — 400° С образуется гидрид NaH — белый кристаллический порошок, разлагающийся при т-ре выше 425° С.
С кислородом образует несколько соединений, основными из к-рых являются окись Na2О и перекись NaО2.
Облучение паров в среде азота или при воздействии сильного электрического поля приводит к образованию нитрида Na3N.
Пропуская над расплавленным амидом NaNH2 закись N2О, получают азид NaN3 — белое кристаллическое вещество.
С галогенами образует галогениды NaF, NaCl, NaBr и Nal.
При взаимодействии с фтором натрий воспламеняется даже при комнатной т-ре, реакция с йодом идет лишь при нагревании до т-ры 300—360° С.
Получено несколько халькогенидов — соединений металла с серой, селеном и теллуром.
С углеродом при т-ре 800—900° С пары образуют карбид Na2C2 очень гигроскопичный белый порошок.
С кремнием и бором не реагирует даже при очень высокой т-ре.
При нагревании с фосфором в вакууме образуется фосфид Na3P, весьма неустойчивое во влажном воздухе соединение.
Со многими металлами натрий образует сплавы.
В реакциях с различными неорганическими соединениями ведет себя как сильный восстановитель.
Едкий натр
Оксид натрия присоединяя воду, превращается в едкий натр — один из важнейших продуктов основной химической промышленности.
В заводском масштабе его получают электролизом водного раствора хлорида натрия (электролитический едкий натр) или взаимодействием карбоната натрия с гидроксидом кальция (каустическая сода):
Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓
Химически чистый гидроксид натрия — бесцветное кристаллическое гигроскопичное вещество, на воздухе покрывается налётом карбоната натрия:
2NaOH + CO2 = Na2CO3 + H2O
Едкий натр используют в мыловаренной, кожевенной, текстильной, фармацевтической промышленности, а также в сельском хозяйстве.
Изотопы
Природный натрий состоит из стабильного изотопа 23Na.
Получены радиоактивные изотопы 20Na, 21Na, 22Na, 24Na и 25Na с периодами полураспада соответственно 0,385 и 23,000 сек; 2,6 года; 15,0 ч и 60 сек.
Получение
В пром. масштабах металлический натрий получают термохимическим восстановлением соединений, содержащих этот металл, или электролизом pacплава едкого натра либо хлорида натрия.
Наиболее экономичный, способ электролиз расплава хлорида натрия, в к-рый вводят добавки хлоридов калия и кальция, фторида натрия и др. для снижения температуры плавления соли от 801 до 575° С.
Наряду с Na при электролиз получают хлор.
Электролиз солей расплавов проводят в электролизёрах с диафрагмой, имеющих аноды, изготовленные из графита, и катоды выполненные из меди или железа.
Его соединения и сплавы находят широкое применение.
Применение
Так натрий и его сплавы с калием используют как:
- Теплоносители в клапанах авиационных двигателей.
- В машинах для литья металлического магния под давлением.
- В процессах термообработки для получения равномерных т-р в обширных зонах.
- При крекинге нефти.
- Химических реакторах, когда процессы ведут при т-ре до 650° С.
Сплавы с калием отличаются малыми сечениями поглощения тепловых нейтронов и применяются как теплоносители в ядерных установках, вырабатывающих электр. энергию на морских атомных судах и подводных атомных лодках.
Высокая электропроводность позволяет использовать его для заполнения фидеров, по к-рым можно пропускать тысячи ампер пост. тока.
Пары натрия используют в газосветных лампах для освещения автомобильных дорог и взлетно-посадочных полос аэродромов.
Модифицирование металлическим натрием значительно улучшает прочностные характеристики алюминиевых сплавов.
Свинцовонатриевые сплавы применяют для изготовления подшипников, в производстве тетраэтилсвинца, одного из сильнейших антидетонаторов.
Присадки повышают смачиваемость ртути, что используется в ртутно — паровых установках, при амальгамации стальных поддонов электролизных ванн.
Активный восстановитель для таких редких металлов, как тантал, титан и цирконий.
Соли натрия
Большинство солей натрия хорошо растворимо в воде. Многие из них образуют кристаллогидраты: Na2CO3 · 10H2O, Na2SO4 · 10H2O, Na2S2O3 · 5H2O и т.д.
Соли натрия необходимы человеку и животным , так как натрий входит в состав плазмы крови.
Ежегодно с пищей человек употребляет 5 — 10 кг хлорида натрия.
Хлорид натрия NaCl — широко применяется для консервирования продукции сельского хозяйства и приготовлении пищи.
Нитрат натрия (натриевая селитра) NaNO3 — распространённое азотное удобрение с нитратной формой азота.
Карбонат натрия кристаллический Na2CO3 · 10H2O, или кристаллическая сода, выделяется из за некоторых озёр (содовые озёра), синтезируются в заводских масштабах.
В огромных количествах потребляется мыловаренной, стекольной, текстильной, бумажной и нефтяной промышленности.
Карбонат натрия безводный Na2CO3 или кальцинированная сода, вырабатывается в наибольших количествах.
Гидрокарбонат натрия NaHCO3 (сода пищевая) используется в кондитерском деле в место дрожжей, в медицине и лабораторной практике.
Соли натрия накапливаются в почвах засушливых районов, вызывая засоление.
Засоленные почвы (солонцы, солончаки, солоди) содержат много карбоната Na2CO3, сульфата Na2SO4, хлорида натрия NaCl.


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.