Сера это химический элемент, типичный не металл, простое вещество имеет формулу S, английское название Sulfur, как кислород и другие элементы имеет аллотропное состояние это объясняется тем, что молекулы имеют различное строение атомов.
Сера в природе встречается в самородном состоянии в виде игольчатых соединений в основном в местах вулканической активности, а также в виде минералов.
Основное применение в производстве серной кислоты, искусственной резины, соединений на основе серы.
Что такое сера
(Sulfur), S — химический элемент 16-й группы (по устаревшей VI группы периодической системы элементов;).
Атомный номер 16, атомная масса 32,06.
Характеристика химического элемента сера. Светло-желтые ромбические кристаллы.
В соединениях проявляет степени окисления —2, +2, +3, +4, +5 и +6.
Изотопы
Природная сера состоит из стабильных изотопов 32S (95,02%), 33S (0,75%), 34S (4,21%) и 36S (0,02%).
Известны искусственные радиоактивные изотопы 29S, 30S, 31S, 36S, 37S и 38S с периодами полураспада соответственно 0,195; 1,35 и 2,40 — 3,18 сек; 87,9 дней; 5,04 и 172 мин.
Содержание в земной коре
Сера применяли с древних времен для изготовления косметических средств, меди препаратов, красок, отбеливания тканей, дезинфекции и т. п.
По распространенности в природе занимает 15 место среди др. элементов.
Ее содержание в земной коре 5 х 10-2%, в мировом океане 9 х 10-2%. В природе встречается в виде серы самородной и в виде соединений.
Например сульфидов (антимонит Sb2S3, аргентит Ag2S, арсенопирит FeAsS, галенит PbS, кобальтин CoAsS, ковален CuS, киноварь HgS, пирит FeS2) и сульфатов (ангидрита CaSО4, барита BaSО4, гипса CaSО4·2H2О).
Кроме того, сера содержится в каменных углях, битумных сланцах, нефти, водах различных горячих минер, источников.
Растительных и животных тканях, газах вулканического происхождения и т. п., также служащих сырьем для пром. получения серы.
Известно несколько модификаций с энантиотропными формами являются ромбическая α-S, устойчивая ниже т-ры 95,60 С, и моноклинная β3-S, устойчивая выше т-ры 95,6° С.
Физические свойства
Чистая сера — это хрупкое кристаллическое вещество желтого цвета, хорошо растворима в сероуглероде, бензоле, анилине; в воде она не растворяется.
Сера плохо проводит теплоту и электричество.
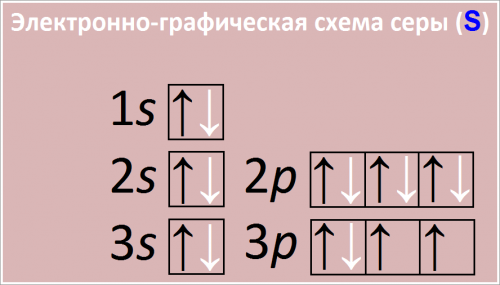
Электронная формула атома серы:
1s2 2s2 2p6 3s2 3p4
Сокращенная электронная конфигурация S:
[Ne] 3s2 3p4
У серы несколько аллотропических модификаций:
- Ромбическая (или октаэдрическая).
- Призматическая (или моноклинная).
- Пластическая.
Кристаллы ромбической серы имеют форму октаэдров плотность ее 2,07 г/см³, плавится при 112,8° С.
При медленном охлаждении расплавленной серы получается моноклинная модификация плотностью 1,96 г/см³ с температурой плавления 119 °С.
Кристаллы ее постепенно превращаются в ромбическую серу как наиболее устойчивую.
Если расплавленную и нагретую почти до кипения серу быстро охладить (вливая струей в холодную воду), получается коричневая резиноподобная масса — пластическая сера.
Однако она тоже неустойчива и при хранении превращается в ромбическую.
Химические свойства серы
В химическом отношении сера — это типичный неметалл, активно взаимодействует со многими металлами, образуя сульфиды.
Реагирует сера и с некоторыми неметаллами: кислородом, водородом (при нагревании), галогенами.
Например, пропуская хлор в расплавленную серу, получают хлорид серы, в котором она проявляет степень окисления +1.
Молекулярная масса хлорида серы, определенная по плотности пара, соответствует формуле S2Cl2.
Это жидкость имеет температуру кипения 137° С, растворяет серу, которая разлагается водой:
S2Cl2 + 2H2O = 2HCl + H2S + SO2
Хлорид серы(I) S2Cl2 используют для вулканизации каучука.
Дихлорид SCl2 и тетрахлорид серы SCl4 большого применения не нашли. Из других соединений с галогенами известны бромид серы (I) S2Br2 и фторид серы (VI) SF6.
История открытия серы
Точное время открытия серы не установлено, но этот элемент использовался до нашей эры, известно что ее использовали алхимики в своих деланиях для получения (философского камня).
Сера использовалась жрецами в составе священных курений при религиозных обрядах. Она считалась произведением сверхчеловеческих существ из мира духов или подземных богов.
Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы.
Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников.
Около VIII века китайцы стали использовать её в пиротехнических смесях, в частности, в смеси типа пороха.
Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что её считали «принципом горючести» и обязательной составной частью металлических руд.
Пресвитер Теофил (XII век) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, ещё в древнем Египте.
В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов.
В дальнейшем она стала одним из трёх принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона.
Элементарную природу серы установил Лавуазье в своих опытах по сжиганию.
С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения её из пиритов; последний был распространён в древней Руси.
Впервые в литературе он описан у Агриколы.
Получение серы
Переработка самородной серы заключается в отделении ее от сопутствующих пород (песка, глины, известняка и т. п.).
Выплавляют серу в автоклавах, в которые загружают серный концентрат, смоченный водой, и пропускают перегретый водяной пар при температуре 140—150 С под давлением 6 атм.
При этом расплавленная сера собирается в нижней части автоклава, а затем выпускается через специальные отверстия в формы.
В некоторых странах (например, в США) распространен метод подземной выплавки серы.
Обычно сквозь слой песка к залежам серы прокладывают колонну из трех труб, вложенных одна в другую.
Через наружную трубу нагнетают водяной пар при температуре 160—170° С, плавящий серу под землей, через внутреннюю подают горячий воздух под давлением 10—18 атм.
Тогда по средней трубе расплавленная сера поднимается на поверхность земли.
Получая серу из пирита, нагревают его в специальных печах до 600 °С, и он разлагается с выделением свободной серы:
FeS2 = S + FeS
Получают серу также из полиметаллических сульфидных руд.
Выплавляемую в автоклавах серу называют комовой; она содержит еще много примесей.
Очищают ее перегонкой в специальных печах, соединенных с кирпичными камерами.
Пары серы, поступая в камеру, охлаждаются, и сера осаждается на стенках в виде серного цвета — желтого кристаллического продукта, самого чистого технического сорта серы.
При нагревании камеры выше 120 С пары серы сгущаются в жидкость, застывающую в формах в виде палочек черенковой серы.
Сельское хозяйство получает от промышленности также серу молотую (размол комовой серы) для опыливания растении и серу коллоидную.
Тонкодисперсный продукт, дающий с водой устойчивую суспензию, пригодную для опрыскивания растений.
Выплавка серы
Один из основных способов получения серы — это выплавка из самородных руд.
По геотехническому методу перегретую воду подают по скважине под землю в рудное тело.
После чего выплавившуюся жидкую серы высокой чистоты давлением горячего воздуха поднимают на поверхность.
Применяют термические методы, по к-рым серу выплавляют или испаряют из руды в ретортах либо вращающихся печах.
По экстракционному методу серу извлекают из руды с помощью растворителей, например сероуглерода.
Применяют также пароводяной и флотационный методы, по к-рым используют выплавку в автоклавах острым паром.
Кроме того, серы получают из соединений, например окисляя кислородом воздуха сероводород, водяной, генераторный, коксовый и природный газы, газы крекинга нефти, сульфиды и др.
Либо восстанавливая углем двуокись серы, сульфаты кальция и бария (гипс, тяжелый шпат). Очищают серу дистилляцией.
В зависимости от способа получения различают серу природную комовую (выплавленную из руд) и газовую комовую (полученную восстановлением сульфатной либо окислением сульфидной серы).
Рафинированной называют природную комовую серу, очищенную перегонкой; черенковой — серу, сконденсированную в жидкость, разлитую в формы и закристаллизованную.
Порошкообразную серу полученную конденсацией, называют серным цветом. Особо высокодисперсную серу называют коллоидной.
Применение серы
Сельское хозяйство молотая сера или серный цвет используют для опыливания растений против возбудителей грибковых заболеваний и некоторых вредителей.
Сжигая серу, получают двуокись , которой окуривают зернохранилища и склады, уничтожают амбарных вредителей.
В ветеринарии применяют серные мази для лечения накожных заболеваний. Сера входит в состав многих медицинских препаратов (сульфидина, сульфазола и др.).
Большие количества серы расходует резиновая промышленность на вулканизацию каучука.
Сера используется для изготовления черного пороха, сероуглерода, спичек, некоторых красителей.
Примерно половина всей мировой добычи серы используется в производстве серной кислоты, четверть — в бумажной пром-сти при получении сульфитцеллюлозы.
Остальное — в сельском хозяйстве, резиновой пром-сти, в производстве искусственных волокон, взрывчатых веществ, красителей, медицинских препаратов и др.
Добавки серы улучшают обрабатываемость автоматных сталей и антифрикционные св-ва спеченных антифрикционных материалов.
Сера ухудшает мех. св-ва металлов, вследствие чего их подвергают внепечной обработке — обессериванию.
Ромбическая сера
Ромбическая сера — это вещество желтого цвета, нерастворима в воде, растворяется в сероуглероде, анилине, толуоле, четыреххлористом углероде, феноле и в др. неполярных растворителях, обладает малой твердостью, большой хрупкостью.
Моноклинную серу получают, медленно нагревая ромбическую в интервале т-р 95,6—119,25° С.
Если нагревание вести быстро, то ромбическая сера плавится при т-ре 112,8° С, превращаясь в подвижную жидкость соломенного цвета, называемую лямбда-серой, или циклооктасерой λ-S.
Эта жидкость растворима в сероуглероде.
При резком охлаждении жидкой сера образуется аморфная темно-красная пластическая сера, нерастворимая в сероуглероде и называемая мю-серой, или кетоносерой μ-S.
Метастабильная мю- сера быстро переходит в ромбическую.
При нагревании жидкой серы относительное содержание мю-серы увеличивается.
Вязкость мю-серы больше, чем λ-S, поэтому при нагревании она из подвижной (с вязкостью 0,065 nз при т-ре 155° С) становится вязкой (с вязкостью 933 nз при т-ре 1879 С) жидкостью.
С дальнейшим повышением т-ры вязкость уменьшается до 0,83 nз при т-ре 444,6° С.
Модификации серы
В жидкой серой образуется также пи-модификация по схеме λ — S ⇄ μ — S + π — S Ее можно отделить от мю-серы, используя меньшую растворимость в сероуглероде.
В процессе хранения пи-модификация превращается в μ мю-серу.
При быстром охлаждении раствора серы в бензоле или спирте выделяется твердая нестабильная гамма-модификация.
У ромбической и моноклинной серы, лямбда-серы и пи модификации — восьми-звенное кольцеобразное пространственное строение, у мю-серы — открытые цепочки.
Разрыв кольцеобразных молекул наблюдается при т-ре более 160° С. Выше т-ры 190° С происходит уменьшение длины цепочек.
В парообразном состоянии представлена набором молекул S8, S6, S4 и S2.
При повышении т-ры увеличивается относительное количество молекул с меньшим числом атомов, а выше т-ры 1500° С начинается диссоциация на атомы.
Твердая и жидкая диамагнитна. Парообразная сера (S2) парамагнитна.
Поверхностное натяжение (дин/см): 60,83 (т-ра 120° С); 57,67 (т-ра 150° С) и 39,4 (т-ра 445° С).
Элементарная сера активно взаимодействует со многими металлами, неметаллами, неорганическими и органическими соединениями.
С азотом, йодом, золотом, платиной и инертными газами непосредственно не взаимодействует. К числу важнейших относятся соединения серы с водородом, кислородом и галогенами.
Соединения с водородом
С водородом она образует сульфаны (сероводород H2S, двухсернистый водород H2S2, трех-сернистый водород H2S3 и т. д.). Водные растворы сульфанов обладают св-вами слабых двухосновных к-т.
Водород в них может быть замещен на металлы, галогены, органические радикалы.
Соли сульфанов наз. сульфидами, или полисульфидами. Первый член сульфанов — бесцветный ядовитый газ, обладающий сильными восстановительными св-вами.
Остальные сульфаны — малоустойчивые желтоватые маслянистые жидкости.
Соединения серы с кислородом и галогенами
При сгорании серы и сульфидов в среде кислорода или воздуха образуется сернистый газ SО2, растворяющийся в воде с образованием слабой двухосновной сернистой к-ты H2SО3, соли к-рой (сульфиты) — сильные восстановители.
Каталитическим окислением сернистого газа получают газообразную трехокись серы SО3, при растворении к-рой в воде образуется сильная двухосновная серная к-та H2SО4, соли к-рой наз. сульфатами.
Растворением SО3 в серной к-те получают олеум, состоящий в основном из пиросерной к-ты H2S2О7. Известны малоустойчивые окислы серы S2О, SO, S2О3, SО4, S2О7 и S3O10. С. легко взаимодействует с галогенами.
Соединение с галогенами
Помимо галогенопроизводных сульфанов общей ф-лы SXT2, она образует соединения с фтором — SFe, S2F10 и SF4, с хлором — SCl4.
Получены соединения С. с азотом: азотистая сера N4S4, четырехсерный азот N2S4 и сернистый азот N2S5; с фосфором сера образует тиоангидриды P4S3, P4S6, P4S7 и P4S10; с углеродом — сероуглерод CS2, сероокись COS и др.
Сера в природе
В природной сере четыре стабильных изотопа: ³²S (95,06%), ³³S (0,74%), ³⁴S (4,18%), ³⁶S(~0,014%) искусственно получены еще три изотопа серы, в коре земли серы около 0,1 масс. %.
Встречается она в свободном (самородном) Состоянии и в виде соединений (сульфидов и сульфатов).
Месторождения самородной серы имеются по берегам Волги , на Кавказе, на Камчатке. Богаты самородной серой США, Италия и Япония.
В виде природных сульфидов сера находится в рудах: пирите (железный колчедан) FeS2, медном блеске Cu2S, свинцовом блеске PbS, цинковой обманке ZnS, киновари HgS и др.
Природные сульфаты— гипс СаSO4·Н2O, ангидрит СаSO4, тяжелый шпат ВаSO4, горькая соль MgSO4·7H2O и мирабилит Na2SO4·10H2O, добываемый из вод залива Кара-Богаз-Гол.
Кроме того, с вулканическими газами выделяются двуокись серы SO2 и сероводород H2S.
Последний содержится также в водах минеральных источников (Мацеста, Пятигорск ) и в Черном море (на глубине более-200 м).
Биологическое значение серы
Велико биологическое значение серы: она входит в состав белков растений и животных. А сероводород, выделяющийся при гниении мяса рыбы или яиц, — это продукт разложения белковых веществ.
Особенно богаты серой белки волос человека, а у животных и птиц—белки шерсти, перьев, копыт и рогов.
Соединения, содержащие серу сообщают горький вкус и острый запах хрену, луку, чесноку.
Существуют бактерии, восстанавливающие сульфаты до сероводорода, а также бактерии, окисляющие сероводород до свободной серы .
Элементарная сера не токсична для высших животных, но убивает грибки .
Аллотропия серы
Аллотропия серы обусловлена не разным числом атомов в молекуле, как у кислорода, а различным строением восьмиатомных молекул S8.
При нагревании до 112° С сера превращается в желтую легкоподвижную жидкость, при 250° С приобретает красно-бурый цвет и вязкость, выше 300°С снова становится жидкой.
Наконец, при 444,6° С она закипает, выделяя оранжево-желтые пары. Эти превращения — результат изменений в строении молекул серы. В кристаллах серы молекулы S8 имеют кольчатое строение:
По мере нагревания кольца разрываются и образуются молекулы с открытой цепью атомов:
Расплавленная сера состоит еще из молекул S8, S6, пары ее содержат уже молекулы S6, S4 и S2.
Термическая диссоциация молекул S2 на атомы наблюдается при температуре 1700° С.
Что мы узнали о сере?
Сера – кристаллический неметалл жёлтого цвета. Схема строения атома – +16 S)2)8)6. Проявляет три степени окисления: -2, +4, +6. Известно 24 изотопа серы.
Это активный элемент, вступающий в реакцию с металлами и неметаллами. Образует соли – сульфиты и сульфиды, а также серную кислоту.
Сера нерастворима в воде и соляной кислоте. Входит в состав живых организмов. В природе находится в свободном и связанном виде.
Чем опасна сера для здоровья
По информации ВОЗ, воздействие диоксида серы в концентрациях выше ПДК может вызвать нарушение функций дыхания.
Не исключено действие на слизистые оболочки, воспаление носоглотки, трахеи, бронхиты, кашель, хрипота и боль в горле.
Для чего используют серу
Серу используют для производства серной кислоты, изготовления спичек, черного пороха, бенгальских огней, для борьбы с вредителями сельского хозяйства и лечения болезней, в производстве красителей, взрывчатых веществ, люминофоров.
Серная кислота – один из важнейших продуктов основной химической промышленности.
Как выглядит сера в природе
Это кристаллическая сера — хрупкое вещество жёлтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями.
Как можно получить серу
Сера добывается из серных руд или смесей содержащих серу. Воду наливают в свинцовые чаны и вываривают до выделения серы.
Если смесь такой серы с железными опилками нагреть, положить в горшки и замазать их глиной и очищенной серой, то получится другой вид серы, называемый «конской серой».




Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.