Кислород это газ без цвета, запаха и вкуса. Мало растворим в воде: в 100 объёмах воды при 20 °C.
При нормальном давлении он сжижается при — 183°C. И затвердевает при — 219°C. В жидком и твёрдом состоянии имеет бледно – синюю окраску.
Молекула кислорода — двухатомная, неполярная.
Что такое кислород
(Oxygenium), О — химический элемент 16 группы, по устаревшей элемент VI группы периодична системы элементов.
Атомный номер 8, атомная масса 15, 9994. В норм, условиях — газ без цвета, запаха и вкуса.
При образовании большинства соединении приобретает электроны.
В окислах (например Н2O, Li2O, СаО, Аl2O3, SiO2, Р2O6, SO3, Сl2O7), кислородных к-тах и их солях кислород проявляет формально степень окисления — 2.
В пероксосоединениях (Н2O2, Na2O2, Ва2O2) есть кислородный перекисный мостик — О⁻ — О⁻ — с межъядерным расстоянием 1,48 А.
В надперекисях (КO2, RbO2 GsO2) содержится группа O-2 с межъядерным расстоянием 1,26 А, в озонидах (КO3, RbO3, CsO3) — парамагнитный анион O- 3.
Только в соединениях с фтором (F2O, F2O2) и в солях диоксигенил-катиона.
Например гексафтороплатинате (+ 5) диоксигенила O2 [PtF6], кислород проявляет степень окисления + 1.
Кто открыл кислород
Открыли К. швед, химик К. В. Шееле — в 1771 (работы его опубликованы в 1777) и независимо от него англ. ученый Дж. Пристли — в 1774. Франц. химик А. Л. Лавуазье повторил опыты Дж.
Пристли (термическое разложение окиси ртути), дал элементу название и к 1777 создал кислородную теорию горения, дыхания и окисления.
Считается самым распространенным в земной коре элемент: содержание его составляет 47,0% по массе, или 55 ат.%.
Физические свойства
Кислород образует два простых вещества: кислород газ и озон О3. При высоких давлениях возможно образование молекул O4. Кислород — трудно сжижающийся газ.
Основные термодинамические параметры — критическая точка: т-ра 154,8 К (-118,4° С); давление 50,14 ат; плотность 0,406 г/см3; тройная точка: температура 54,36 К (-218,8° С); давление 1,54 • 10-3 am.
Т-ра кипения 90,18 К (-182,97° С) при давлении 760 мм рт. ст., теплота испарения 51,0 ккал/кг; плотность жидкого К. (т-ра 90,18 К) 1,142 г/см3.
Температура плавления 54,36 К (-218,8° С); теплота плавления 3,3 ккал/кг.
Кристаллическая модификации: кубическая, устойчивая выше т-ры 43,77 К (-229,4° С).
С плотностью 1,27 г/см3 при т-ре -219° С; гексагональная, устойчивая от 23,85 К (-249,3° С) до 43,77 К, и ромбическая, устойчивая при т-ре ниже 23,85 К, с плотностью 1,426 г/см3.
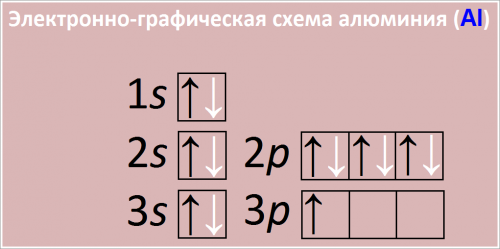
Электронная формула атома алюминия:
1s2 2s2 2p6 3s2 3p1
Сокращенная электронная конфигурация Al:
[Ne] 3s2 3p1
Жидкий кислород
Жидкий кислород — светло-голубого цвета, притягивается магнитам; твердый — синие кристаллы.
Во всех агрегатных состояниях парамагнитен.
Диэлектрическая постоянная газа — 1,000507, жидкого О — 1,491. Масса 1 а газа при т-ре 0° С и давлении 1 ат равна 1,42897 г/л.
Коэффицент теплопроводности 58,3 • 10-6 кал/сек • см • град; теплоемкость Ср = 6,99 и cν = 4,98 кал/моль • град; cp/cν = 1,403.
Растворимость кислорода в воде (в 100 см3) при т-ре 0°С составляет 4,9 см3, при т-ре 20° С равна 3,1 см3.
Хорошо растворяется в органических растворителях и затвердевании расплава, разбрызгивая металл, хорошо поглощается также тонкими порошками металлов и угля.
Молекула О2 очень прочна (межъядерное расстояние 1,207 А), распад ее на атомы начинается выше т-ры 1500° С и становится полным при т-ре 5000° С.
Энергия атомизации D298 = 119,12 ккал/моль.
Под действием ультрафиолетового излучения (А, — 190 нм) легко осуществляется фотолиз кислорода.
Переменная степень окисления О2, способность к принятию электронов от атомов др. элементов (сродство к электрону 1,47 эв/атом).
Возможность отдачи своего электрона (1-й потенциал ионизации — 13,6 в, электроотрицательность по шкале Полинга 3,5) обусловливают возможность образования твердых растворов в металлах и различного рода стехиометрических и нестехиометрических соединений.
Кислород образует соединения со всеми элементами, кроме гелия, неона и аргона.
Химические свойства
На основе типов и св-в кислородных соединений строится классификация неорганических соединений.
Увеличение содержания кислорода в молекуле окисла усиливает кислотный характер этого окисла, например МnО проявляет основные св-ва.
А Мn2O7 является ангидридом марганцевой (перманганатной) кислоты НМnO4.
При обычных условиях взаимодействие с кислородом веществ, способных его присоединять, протекает в большинстве случаев медленно.
При нагревании, под действием тихого или искрового электр. разряда, под давлением и при наличии катализатора скорость реакции значительно возрастает.
Катализатором для очень многих реакций с О2 является вода:
Абсолютно сухой кислород при комнатной т-ре не взаимодействует с металлическим калием, с белым фосфором.
Большинство реакций кислорода с различными веществами экзотермичны.
Некоторые из них используются для получения энергии в форме тепла и света (горение): в процессе сжигания угля, различных углеводородов, древесины, торфа и др.
В смеси с горючими газами и парами, с тонкими порошками мн. металлов и органических веществ О2 -газ образует взрывчатые смеси (оксиликвиты).
Кислород непосредственно реагирует почти со всеми простыми веществами за исключением:
- Галогенов.
- Инертных газов.
- Платины.
- Золота.
- Соединения с к-рыми получаются косвенным путем.
Наиболее важным химическим свойством кислорода является его способность соединятся с большинством простых веществ с выделением теплоты и света.
Чтобы вызвать горение веществ в кислороде, часто приходится нагревать их до определённой температуры — температуры воспламенения.
Так как при обычной температуре кислород является довольно инертным веществом.
Наряду с горением известны многочисленные процессы медленного окисления при участии кислорода:
- Дыхание живых организмов.
- Ржавение металлов.
- Гниение.
- Тление и т.д.
Выделяющая при этом теплота рассеивается в окружающее пространство, но в определённых условиях она может скапливаться и тогда происходит воспламенение.
Так самовоспламеняются масляные тряпки, влажное сено и т.д.
Все окислительные процессы протекают гораздо быстрее в чистом кислороде, чем на воздухе.
Например, лучина тлеющая на воздухе, при внесении в сосуд с кислородом вспыхивает и ярко горит.
Изотопы
Природный кислород состоит из стабильных изотопов 16О (99,759%), 17О (0,037%) и 18О (0,204%).
Получены радиоактивные изотопы 14О, 15О и 19О с периодами полураспада соответственно 72,1 сек, 2,1 мин и 29,4 сек.
Получение в лабораторных условиях
В лабораторных условиях кислород получают:
- Термическим разложением окислов (например, СrO3).
- Перекисей (например, ВаO2).
- Солей кислородных кислот (например, КМnO4).
- Каталитическим разложением Н2O2.
- Электролизом 30%-ного раствора калия гидроокиси с никелевыми электродами.
В промышленности кислород получают фракционированной перегонкой жидкого воздуха, а также как побочный продукт при получении водорода электролизом воды.
Кислород можно получать также из воздуха избирательной диффузией при повышенном давлении через пластмассовые мембраны (молекулярные сита).
В промышленности кислород получают в основном фракционированной разгонкой жидкого воздуха. Его хранят и перевозят в стальных баллонах.
В лаборатории его получают разложением соединений, богатых кислородом. Чаще всего для этого используют хлорат или перманганат калия (KMnO4).
Разложение KMnO4 происходит по реакции:
2KMnO4 = K2MnO4 +MnO2 + O2
Кислород в природе
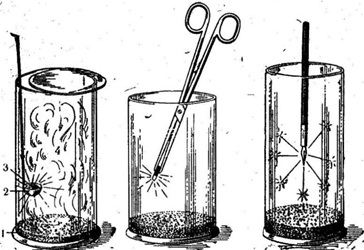
Рис. Горение натрия. Горение угля. Горение железа в кислороде.
В форме газа O2 в воздухе находится 1,2 Х 104 т, что составляет 20,95 об.%, или 23% по массе.
В нижних слоях стратосферы содержится очень небольшое количество озона O3, образующегося под действием ультрафиолетового излучения Солнца.
А выше 80 км — атомы, образующиеся вследствие распада молекул O2, O3 и водяного пара под действием коротковолнового излучения.
Кислород в воде — 88,8%, в водах мирового океана — 85,7%; в природных водах растворено около 1,5• 1013 m кислорода.
Из минералов, содержащих кислород (их около 1400), наиболее распространены кварц и его модификации (53% К.), полевые шпаты, слюды и известняки (45—48%), окислы железа (28—43%), гипс и глины (около 55%).
Кислород — самый распространённый элемент на нашей планете: он составляет 49% от массы земной коры, гидросферы и атмосферы вместе взятых.
В воздухе находится около 21% ( об. ) или 23 ( масс. ) кислорода.
Кислород воздуха непрерывно расходуется при дыхании, в процессе горения, гниения и т.д.
Его количество в воздухе всё время пополняется на солнечном свету.
Общее количество кислорода, выделяемых растениями в атмосферу в процессе питания, примерно в 6 раз больше чем потребляемого ими для дыхания.
Кислород весьма распространён в природе в виде соединений.
Он входит в состав всех важнейших горных пород:
- Гранитов.
- Гнейсов.
- Песка.
- Сланцев и многих других.
В воде содержится 88,89% (масс.) кислорода.
Доступная нам часть твёрдой земной коры содержит 47,3% (масс.) кислорода (в виде оксидов и кислородных солей).
Кислород как элемент входит в состав тела человека, животных и растений.
Содержание кислорода в живых организмах составляет около 65% (масс ) велико значение кислорода в технике и промышленности.
Выпускают кислород
Выпускают кислород как газ технический, технологический, медицинский и жидкий технический.
Содержание:
- Газообразный технический первого сорта содержит O2 не менее 99,7%.
- Второго сорта — не менее 99,5%.
- Третьего сорта — не менее 99,2%.
- Технологический — не менее 95—98,5%.
- Медицинский — не менее 99,5%.
Медицинский кислород не должен содержать воды, масла, окиси углерода, ацетилена, газообразных оснований и к-т, озона и др. газов-окислителей.
Допускается наличие двуокиси углерода (смесь O2 с 5—7% СO2 наз. «карбоген»). Из 1 кг жидкого O2 образуется 0,75 м3 газа, из 1 л — 0,86 м3.
Применение кислорода
Кислород применяется в черной и цветной металлургии, хим. пром-сти, машиностроении, энергетике и др. областях для получения высоких т-р (порядка 2500—3000° С).
Для интенсификации технологических процессов.
Замена воздуха кислородом снижает расход топлива и увеличивает производительность доменных мартеновских печей, вагранок, конверторов, электр. печей на 25 -30% и более, повышает качество выплавляемого металла.
На выплавку 1 т чугуна расходуется O2 около 1000 м3, на 1 т конверторной стали — около 80 , на 1 т мартеновской стали — 15—25 м3.
В цветной металлургии на 1 т металла расходуется 10 000 — 30 000 м3 O2.
Большое количество кислорода используют для автогенной сварки и резки, для газификации твердого топлива в кипящем слое, для огневого бурения твердых горных пород и др.
Жидкий кислород — основа мощных взрывчатых веществ — оксиликвитов (пропитанных жидким O2 пористых горючих материалов, например древесных опилок); применяется в ракетных двигателях.
Применение в промышленности
При сжигании горючих газов в специально сконструированных горелках в токе чистого кислорода, температура пламени резко повышается по сравнением с пламенем на воздух.
Пламя водорода, сжигаемого в токе кислорода, достигает 2000 градусов, а ацетилена — 3000 градусов.
Пламенем таких горючих газов пользуются для:
- Сварки и резки металлов.
- Для плавления платины.
- Кварца и других очень тугоплавких материалов.
Взрывчатые вещества
Жидкий кислород или жидкий воздух, сильно обогащённый кислородом, применяют для изготовления взрывчатых веществ (оксиликвитов).
Последнее представляет смесь пористого угля или других горючих составляющих (нефть, парафин, нафталин) с жидким воздухом.
Другое применение
Жидкий воздух применяют, в частности, как одна из составляющих при заправки ракет.
Кислород широко используют для интенсификации ряда процессов металлургической и химической промышленности.
Большое значение в применении кислорода в специальных аппаратах, используемых экипажами самолётов, подводных лодок, горно — рудном деле, в медицине и т.д.
Часто задаваемые вопросы и ответы о кислороде?
Что такое формула О2 в химии?
Кислород — это газообразный химический элемент. Он обозначается символом O, имеет атомный номер 8 и атомный вес 15,9994, а его молярная масса 32 г/моль. Формула О2.
Что такое атомарный кислород?
Атомарный кислород – это очень активный химический элемент, имеющий символ O. Он является свободным радикалом.
Это означает, что атомарный кислород имеет неспаренный электрон, что делает этот атом очень реактивным.
Как охарактеризовать химический элемент?
Самый распространённый на Земле химический элемент. В виде газа. содержится в воздухе. (% по объёму), входит в состав минералов и других веществ, образующих земную кору.
Сильный окислитель, при нагревании реагирует со многими простыми и сложными веществами.
Когда открыли?
Официально считается, был открыт английским химиком Джозефом Пристли 1 августа 1774 года путём разложения оксида ртути в герметично закрытом сосуде (Пристли направлял на это соединение солнечные лучи с помощью мощной линзы).
Чему равна относительная атомная масса?
Относительная атомная масса равна 15, 9994. Но как правило округляют и пишут Ar O=16.


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.