Сера. Аллотропия. Свойства. Сера в природе
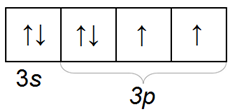
Сера S имеет атомный вес 32,064. Электронная конфигурация атома серы 1s2s22р63s23р4
Размещение электронов на орбиталях внешнего слоя
Валентных электронов у атома серы 6. Поэтому, ceра может образовывать до 6 валентных связей.
Атом серы имеет больший радиус и потому проявляет меньшую электроотрицательность по сравнению с кислородом.
Степени окисления, которые может проявлять сера в окислительно-восстановительных реакциях:
S0, S-2, S+4, S+6.
Сера может образовывать несколько аллотропных видоизменений. Это ромбическая (октаэдрическая), пластическая и моноклиническая сера.
Ромбическая сера является наиболее распространенным аллотропным видоизменением серы. Это кристаллическое вещество лимонно-желтого цвета, кристаллизующееся в виде октаэдров.
Плотность ромбической серы 2,07 г/см3.Плавится она при температуре 112,8°, кипит при 444,6°, в воде не растворима, но хорошо растворяется в сероуглероде, бензоле и других органических растворителях.
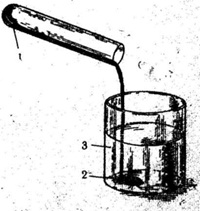
Пластическая сера получается, если нагреть ромбическою серу почти до кипения и затем быстро вылить в стакан с холодной водой (рис. 1).
Эта модификация серы обладает пластичностью в отличие от весьма хрупкой ромбической серы.
Пластическая сера довольно быстро переходит в ромбическую. Пластическую серу, образующуюся при резком охлаждении расплавленной серы, иногда рассматривают как не успевшую сформироваться ромбическую серу.
Рис. 1. Пластическая сера. 1- расплавленная сера 2- пластическая сера 3- вода.
Моноклиническая сера получается при медленном охлаждений расплавленной серы на воздухе.
При этом образуются длинные нитевидные кристаллы, которые при стоянии тоже превращаются в октаэдры.
Существование электронных видоизменений у серы объясняется различием кристаллических структур.
Если октаэдрическая сера имеет молекулы в виде, восьмичленных колец, то молекулы пластической серы— длинные, беспорядочно расположенные цепочки разной величины.
Моноклиническая сера близка по структуре к октаэдрической.
66. Чем вызывается возникновение аллотропных видоизменений?
67. Какие аллотропные видоизменения серы вам известны и какое из них наиболее устойчивое? (См. Ответ)
Сера это
В химическом отношении сера является активным веществом. Она довольно легко реагирует со. многими металлами.
Во всех случаях образуются сульфиды, например при нагревании с алюминиевым или цинковым порошком.
Если растирать металлический натрий в ступке с серой, то между ними происходит реакция, сопровождающаяся вспышками и резким звуком.
Опыт следует Проводить в защитных очках, обернув руку полотенцем, и с очень малыми количествами веществ.
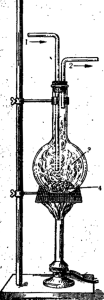
При пропускании водорода через пары серы образуется сероводород (рис. 2).
69. Какова степень окисления серы в соединениях с водородом и металлами?
70. Какого типа химическая связь в соединениях серы с металлами?.
71. Почему сульфиды цинка и алюминия нельзя получить реакцией обмена в растворах?
72. Сколько сульфида железа (II) получится, если взято 30 г железа и 16 г серы и если взятое железо используется лишь на 90%? (См. Ответ)
Рис. 2. Прибор для наблюдения взаимодействия серы с водородом:
1—водород; 2 — сероводород; 3- пары серы; 4 — расплавленная сера.
Возможны и другие реакций, в результате которых сера приобретает положительные степени окисления.
Обычно это бывает при непосредственном взаимодействии серы с кислородом — при горении серы:
S + О2 = SO2
Поскольку у кислорода величина электроотрицательности больше, чем у серы, то в соединении SО2 сера проявляет степень окисления +4 и в данной реакции ведет себя как восстановитель.
Более глубокое окисление воды до степени окисления +6 возможно при образовании серного ангидрида.
В присутствии катализатора при температуре 400—500° двуокись серы окисляется кислородом, образуя серный ангидрид:
2SО2 + О2 = 2SО3
Сера цвет
Несмотря на высокую химическую активность, сера довольно широко встречается в виде минерала, который называется самородной серой.
Это почти исключительно ромбическая сера.
Прочие аллотропные видоизменения серы в природе не встречаются, химически чистая сера имеет лимонно-желтый цвет.
Аналогично такую же окраску имеет вулканическая сера, но при условии, что в ее состав не входят другие вещества или минералы (сульфиды).
Сера обычно вкраплена в различные горные породы, из которых довольно легко может быть выплавлена.
Самородная сера чаще всего имеет вулканическое происхождение. Богаты Самородной серой Кавказ, пустыня Кара-Кум, Керченский полуостров, Узбекистан.
Сера встречается также в виде сернистых металлов сульфидов (пирит FeS2, цинковая обманка ZnS, свинцовый блеск PbS), в виде сульфатов (глауберова соль Na2SO4 · 10H2O, гипс CaSО4 · 2H2О).
Сера входит в состав некоторых белков.
Для того чтобы извлечь серу из породы, ее выплавляют в автоклавах действием перегретого водяного пара при 150—160°.
Полученную расплавленную серу рафинируют (очищают) возгонкой.
Если ее расплавить и разлить по деревянным формочкам, то она затвердевает в виде палочек. Такую серу называют черенковой.
Иногда серу выливают в большую форму, а после затвердевания раскалывают на мелкие бесформенные куски.
Такая сера называется комовой. Наконец, серу можно получить в виде мелкого распыленного порошка — так называемого серного цвета.
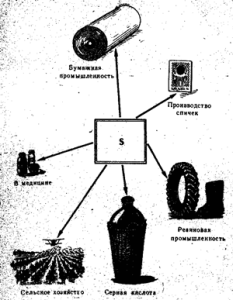
Свободная сера применяется главным образом в производстве серной кислоты, а также в бумажной промышленности, для вулканизации каучука.
В производстве красителей, в сельском хозяйстве для опыления и окуривания винограда и хлопчатника, в производстве спичек (рис. 3).
В медицине сера используется в виде мазей вместе с другими веществами против чесотки и других кожных заболеваний. Чистая сера не ядовита.
■ 73. Перечислите химические свойства серы я укажите, в чём сходство и в чем различие серы и кислорода. (См. Ответ)
Соединения двухвалентной серы
Двухвалентная сера образует соединения с водородом (сероводород H2S) и металлами (сульфиды Na2S, FeS).
Сульфиды можно рассматривать как производные сероводорода, т. е. соли сероводородной кислоты.
Сероводород
Молекула сероводорода построена по полярному типу связи:
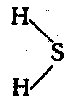
Сероводород—газ тяжелее воздуха, с резким неприятным запахом тухлых яиц. Этот газ очень ядовит. Наши органы обоняния весьма чувствительны к сероводороду.
При наличии 1/2000 части сероводорода в воздухе может наступить потеря обоняния.
Хроническое отравление сероводородом в малых дозах вызывает исхудание, головные , боли.
В случае более сильных отравлений через некоторое время может наступить обморок, а очень сильные концентрации вызывают смерть от паралича дыхания.
При отравлениях сероводородом необходимо вынести рольного на свежий воздух и дать ему вдыхать небольшие количества хлора, а также чистый кислород.
Предельно допустимая концентрация сероводорода в рабочем помещении 0,01 мг/л.
Сероводород переходит в жидкое состояние при температуре —60°. Он хорошо растворяется в воде, образуя при этом сероводородную воду H2Saq или, как ее еще называют, сероводородную кислоту.
Сероводород — один из лучших восстановителей.
Он легко восстанавливает бромную и хлорную воду в бромисто водородную или соляную кислоту:
Сероводород горит. При достаточном доступе воздуха (рис. 4,а) происходит полное сгорание по уравнению:
Если доступ воздуха недостаточный или если в пламя сероводорода внести холодный предмет (рис. 4,б), то происходит неполное сгорание по уравнению:
2H2S + О2 = 2S + 2H2O
Здесь окисление серы идет менее глубоко—до S(0).
■ 74. Назовите меры первой помощи при отравлениях сероводородом. (См. Ответ)
75. Почему сероводородную кислоту часто называют сероводородной водой?
76. При смешивании йодной воды с сероводородной происходит обесцвечивание и помутнение раствора. Чем это объяснить?
77. Возможно ли для S(-2) проявление окислительных свойств? (См. Ответ)
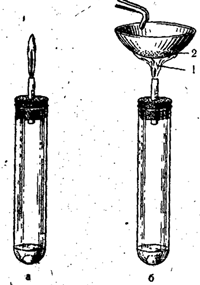
В лаборатории сероводород получают в аппарате Киппа при взаимодействии сульфида железа (или сульфида натрия) с разбавленной серной кислотой:
FeS + H2SO4 = FeSО4 + H2S↑
Сероводород, растворяясь в воде, образует слабую сероводородную кислоту, диссоциирующую двух-ступенчато:
H2S ⇄ Н+ + HS— ⇄ 2Н+ + S2-
Вторая ступень протекает в незначительной степени.
Сероводородная кислота не может храниться в лаборатории длительное время вследствие своей неустойчивости.
Она постепенно мутнеет в результате выделения свободной серы:
H2S = H2 + S
В окислительно-восстановительных реакциях сероводородная кислота ведет себя как типичный восстановитель.
Например :
H2S + К2Cr2O7 + H2SO4 → • • (S0; Cr+3)
• Уравнение этой окислительно-восстановительной реакции закончите самостоятельно.
Сероводород применяется в аналитической химии.
Сероводородная кислота проявляет общие свойства кислот. Правда, не все свойства кислот удается наблюдать на ней.
Например, такие металлы, как цинк, железо, с ней не реагируют, а натрий и кальций, попадая в сероводородную, кислоту, реагируют не с ней.
А с имеющейся там водой, образуя щелочь, которая затем может вступить в реакцию с сероводородной кислотой.
Так как это кислота двухосновная, она может образовывать два ряда солей — сульфиды и гидросульфиды, или бисульфиды.
Средние соли сероводородной кислоты — сульфиды — нерастворимы в воде, кроме солей натрия и калия, и имеют различную окраску: сульфид свинца и железа — черную, цинка — белую, кадмия — желтую.
Гидросульфиды хорошо растворимы в воде.
Реактивом на ион двухвалентной серы S2- является ион кадмия Cd2+, который в соединении с ионом дает желтый, нерастворимый в воде осадок, например:
Cd(NO3)2 + H2S = CdS↓ + 2HNO3
Cd2+ + S2- = CdS
Сульфиды довольно легко гидролизуются по типу солей слабых кислот, поэтому обычно их получают прямым взаимодействием серы с металлом.
■ 78. Напишите уравнение реакции сероводородной кислоты с едким натром и объясните результат реакции, учитывая гидролиз соли в растворе. (См. Ответ)
79. В санитарно-гигиенических исследованиях для обнаружения В воздухе сероводорода пользуются очень чувствительной реакцией с растворимыми солями свинца. Что можно наблюдать при этой реакции в полной ионной и сокращенной ионной формах? (См. Ответ)
Соединения четырехвалентной серы
Соединение четырехвалентной серы — двуокись серы (сернистый газ) SО2. Двуокись серы тяжелее воздуха и имеет резкий неприятный запах.
Молекула двуокиси серы построена также по ковалентному типу связи, полярность ее слабо выражена.
При —10° и атмосферном давлении двуокись серы превращается в жидкость, а затвердевает при —73°.
Она хорошо растворима в воде (на 1 объем воды 40 объемов двуокиси серы), при этом наряду с растворением происходит взаимодействие с водой по уравнению:
SO2 + Н2О = H2SО3
Получающаяся сернистая кислота является весьма непрочной, поэтому реакция обратима. Двуокись серы имеет большое промышленное значение.
Ее получают обжигом серного колчедана FeS2 или серы:
4FeS2 + 11О2 = 2Fe2О3 + 8SО2
S + О2 = SО2
В лаборатории ее получают действием сильных кислот на соли сернистой кислоты, например действием серной кислоты на сульфит натрия:
Na2SO3 + H2SO4 = Na2SО4 + Н2О + SO2
Двуокись серы можно получить разложением солей сернистой кислоты, например сульфита кальция CaSО3, при нагревании:
CaSО3 = СаО + SO2
Двуокись серы ядовита.
При отравлениях ею появляются хрипота, одышка, иногда потеря сознания. Допустимая концентрация SО2 в воздухе равна 0,02 мг/л.
При взаимодействии с органическими красителями двуокись серы может вызвать их обесцвечивание, однако причина этого иная, чем при обесцвечивании хлором.
Не происходит окисления, а возникает бесцветное соединение SО2 с красителем, которое с течением времени разрушается и окраска красителя восстанавливается.
■ 80. Предложите чертежи приборов, с помощью которых можно получить двуокись серы: а) из сульфита натрия действием кислоты: б) прокаливанием сульфита кальция. (См. Ответ)
81. Двуокись серы, полученную при разложении 40 г сульфита кальция, пропустили через 500 г раствора баритовой воды Ва(ОН)2, в результате чего весь барий, находившийся в растворе, был осажден.
Какова процентная концентрация раствора баритовой воды, если 20% двуокиси серы, полученной при обжиге, теряется?
82. К какой группе окислов относится двуокись серы? Перечислите ее свойства, типичные для этой группы окислов. Подтвердите свой ответ уравнениями реакций.
83. Почему при пропускании SО2 через известковую воду возникает помутнение, как и при пропускании СО2?
84. Воздух имеет примесь двуокиси серы. Как освободить его от этой примеси?
85. Какой объем двуокиси серы может быть получен из 20 молей FeS2 при 80% выходе?
86. Через 200 мл 20% раствора едкого натра была пропущена двуокись серы до полного превращения едкого натра в сульфит (гидролиз не учитывать). Какова концентрация образовавшегося раствора сульфита натрия? (См. Ответ)
В связи с тем что степень окисления серы в двуокиси серы равна + 4, т. е. условно с внешнего уровня атома серы отдано 4 электрона.
Для него существуют две возможности:
1. Либо он может дополнительно отдать оставшиеся на внешнем слое 2 электрона и тогда проявит свойства восстановителя,
2. Либо S(+4) может принять некоторое количество электронов и тогда будет проявлять окислительные свойства.
Например, в присутствии сильного окислителя S (+4) ведет себя как восстановитель.
Вr2 + Н2О + SO2 → H2SO4 + НВr
МnO4 + Н2O + SO2 → K2SO4 + MnSO4 + H2SO4
K2Cr2O7 + SO2 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
• Коэффициенты этих реакций найдите самостоятельно.
Особое значение имеет окисление двуокиси серы кислородом в присутствии катализатора V2O5 или Pt при температуре 400—500°, в результате чего образуется серный ангидрид:
2SO2 + О2 = 2SO3
Этот процесс широко используется в производстве серной кислоты контактным способом.
В присутствии сильных восстановителей, например сероводорода, S (+4)ведет себя как окислитель:
H2SO3 + H2S → Н2O + S
• Найдите, составив электронный баланс, коэффициенты для данного уравнения.
Двуокись серы применяется в промышленности для отбелки в тех случаях, когда нельзя применять хлор, в бумажной промышленности.
Для дезинфекции помещений и крупных резервуаров, для уничтожения плесени, паразитов и т. д.
■ 87. Запишите в тетрадь физические и химические свойства двуокиси серы, отметив как реакции, протекающие без изменения степеней окисления, так и окислительно-восстановительные.
88. Каково физиологическое действие двуокиси серы? (См. Ответ)
Как было уже сказано, при растворении двуокиси серы в воде образуется сернистая кислота. Сернистая кислота — кислота средней силы.
Она диссоциирует двух-ступенчато:
H2SO3 ⇄ 2Н+ + HSO3— ⇄ 2Н+ + SO23—
Сернистая кислота нестойкая, быстро разлагается на двуокись серы и воду:
H2SO3 ⇄ H2O + SO2↑
Поэтому провести, например, реакцию с металлами более активными, чем водород, с сернистой кислотой нельзя.
Будучи двухосновной, сернистая кислота может образовывать два ряда солей:
1. Средние — сульфиты,
2. Кислые — гидросульфиты.
Все сульфиты являются нерастворимыми солями, за исключением сульфитов щелочных металлов и аммония. У гидросульфитов растворимость несколько выше.
Эти соли могут разлагаться под действием более сильных кислот:
Na2SO3 + H2SО4 = Na2SО4 + Н2О + SO2↑
2NaHSО3 + H2SO = Na2SО4 + 2H2О + 2SO2↑
При действии кислот на сульфиты выделяется двуокись серы, обладающая неприятным запахом.
Этой реакцией пользуются для того, чтобы отличить соли сернистой кислоты от карбонатов, которые ведут себя аналогично, но двуокись углерода запаха не имеет.
Сульфиты довольно легко подвергаются гидролизу.
Соединения шестивалентной серы
Как уже упоминалось, при окислении двуокиси серы образуется серный ангидрид SО3— соединение шестивалентной серы.
При образовании молекулы серного ангидрида в образовании валентных связей участвуют все валентные электроны серы, как s-,так и р-орбиталей.
Степень окисления +6 для, серы является максимальной положительной. Поэтому S+6 никогда не может вести себя как восстановитель.
Серный ангидрид — белое кристаллическое вещество. Температура плавления его 17°, температура кипения 45°. Серный ангидрид настолько гигроскопичен, что хранить его в обычной посуде нельзя.
Его хранят в запаянных стеклянных ампулах. Серный ангидрид — кислотный окисел, обладающий всеми типичными свойствами этой группы веществ.
В частности, он может реагировать с водой, образуя серную кислоту:
SО3 + Н2О = H2SО4
■ 89. Напишите самостоятельно уравнения реакций серного ангидрида с основаниями и с основными окислами. (См. Ответ)
Серный ангидрид является сильным окислителем. Наиболее важным соединением шестивалентной серы является серная кислота H2SО4.
Она принадлежит к числу сильных кислот.
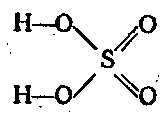
Серная кислота двухосновная и диссоциирует двух-ступенчато:
H2SО4 ⇄ Н+ + HSО4— ⇄ 2Н+ + SO24—
Рис. Структура молекулы серной кислоты.
Что такое серная кислота
Серная кислота — жидкость почти вдвое тяжелее воды. Ее плотность при обычных условиях 1,84.
Серная кислота затвердевает при 10°, 95% раствор ее кипит, при 338°. Запаха и цвета серная кислота не имеет.
С водой она смешивается в любых соотношениях.
Растворение серной кислоты в воде сопровождается выделением большого количества тепла, которое может привести даже к закипанию раствора.
Поэтому при смешивании серной кислоты с водой рекомендуется наливать серную кислоту в воду, а не наоборот.
В противном случае первые порции воды могут закипеть и разбрызгать капли раствора серной кислоты, которые могут причинить сильные ожоги.
Серная кислота — жидкость едкая, поэтому следует избегать попадания ее на кожу и одежду. В случае попадания необходимо быстро смыть ее большим количеством воды, а затем нейтрализовать раствором соды.
Серная кислота интенсивно поглощает влагу из воздуха, поэтому ее часто применяют в эксикаторах. Если в серную кислоту опустить лучинку, то она через некоторое время обугливается.
Это объясняется тем, что серная кислота отнимает у древесины элементы воды — водород и кислород — и оставляет углерод.
Серная кислота является сильной и наиболее стойкой из известных минеральных кислот.
Серная кислота может вытеснить из соли любую кислоту, на чем и основаны лабораторные способы получения различных кислот — азотной, соляной:
2KNО3 + H2SО4 = K2SО4 + 2HNО3
2NaCl + H2SО4 = Na2SО4 + 2HCl
и промышленный способ получения фосфорной кислоты:
Са3(РО4)2 + 3H2SО4 = 2Н3РО4 + 3CaSО4
В разбавленном виде серная кислота, как и все другие кислоты, реагирует с металлами, более активными, чем водород:
Zn + H2SО4 = ZnSО4 + H2↑
С основными окислами:
CuO + H2SО4 = CuSО4 + H2О
С основаниями:
2NaOH + H2SО4 = Na2SО4 + 2H2О
■ 90. Все приведенные реакции ионного типа. Напишите их уравнения в ионной-форме. (См. Ответ)
Качественной реакцией на ион SO24— является реакций с катионом бария, в результате которой выпадает белый осадок BaSО4, нерастворимый в кислотах:
Ва2+ + SO24— =BaSО4
Концентрированная серная кислота —сильный окислитель, особенно при нагревании, так как входящая в ее состав сера в степени окисления S+6 может только принимать электроны, т. е. ведет себя как окислитель.
Если концентрированной серной кислотой капнуть на кусочек сахара,то он обуглится.
Концентрированная серная кислота может реагировать с металлами, менее активными, чем водород, например с медью.
При этой реакции выделяется не водород, а двуокись серы и вода:
Концентрированная серная кислота реагирует с металлами, более активными, чем водород, иначе, чем разбавленная.
Цинк например, из концентрированной серной кислоты не вытесняет водород, а восстанавливает серную кислоту до двуокиси серы, свободной серы или сероводорода:
H2SО4 + Zn → ZnSО4 + SO2
H2SО4 + Zn → ZnSО4 + S
H2SО4 + Zn → ZnSО4 + H2S
■ 91. Все три приведенных уравнения реакций серной кислоты с цинком являются окислительно-восстановительными. Расставьте в них коэффициенты на основе электронного баланса. (См. Ответ)
Безводная серная кислота называется моногидратом. Моногидрат не содержит ионов и поэтому не проводит электрического тока.
Моногидрат хорошо поглощает влагу.
Поскольку многие реакции серной кислоты с металлами являются ионными, моногидрат не вступает в реакцию с некоторыми металлами, более активными, чем водород.
Например с железом, поэтому его можно перевозить в железных цистернах.
Золото, платина устойчивы к серной кислоте в любых концентрациях.
Концентрированная серная кислота окисляет и некоторые неметаллы, например углерод.
■ 93. В чем сходство И различие серной кислоты с другими кислотами? (См. Ответ)
94. Могут ли осуществляться реакции, в которых серная кислота проявляла бы восстановительные свойства?
95. Как осуществить следующие превращения:
Напишите уравнения соответствующих реакций. Для окислительно-восстановительных составьте электронный баланс, уравнения ионных реакций напишите в ионной форме.
96. В одной склянке находится раствор серной кислоты, в другой — азотной, в третьей — соляной. Как их различить?
97. Для получения двуокиси углерода на мрамор СаСО3 действуют соляной кислотой.
Почему для этой цели нельзя применить серную кислоту? (См. Ответ)
98. Как осуществить следующие превращения:
Статья на тему сер, свойства, в природе


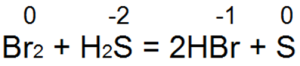
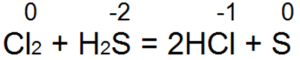
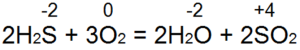



Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.