Молибден это метал, простое вещество, микроэлемент, имеет формулу Мо, отличающиеся исключительной тугоплавкостью.
В чистом виде он представляет собой плотные, твердые, белые и блестящие вещества.
Хорошо обрабатывается прокатной, штамповкой и другими способами.
На воздухе покрывается плотной оксидной шлейкой и поэтому устойчив к действию обычных коррозионных агентов.
Что такое молибден
(Molybdaenum; от греч. — свинец), Мо — химический элемент 6-й группы (химический элемент VI группы устаревший) периодической системы элементов.
Атомный номер 42, атомная масса 95,94.
Светло-серый тугоплавкий металл. В соединениях проявляет степени окисления +2, +3, +4, +5, +6.
Основной минерал молибдена — молибденит (молибденовый блеск) до 18 в. не отличали от графита и свинцового блеска из-за их внешнего сходства.
Близость радиусов обусловливает большее сходство молибдена с вольфрамом, чем этих металлов с хромом. Устойчивость степеней окисления у молибдена , чем у хрома.
Состояние +2 у него почти не встречается, а +3 для Мо , более устойчивы +4 и +6 (у некоторых соединений молибдена степень окисления +5 .
Сходство с элементами подгруппы VIA проявляется в образовании соединений SF6, WF6 , связи в которых в значительной степени ковалентны.
История открытия элемента
Молибден открыл (1778) швед, химик К .В. Шееле, выделивший при обработке молибденита азотной к-той молибденовую к-ту.
Металлический молибден впервые получил (1782) швед, химик П. Гьельм восстановлением трехокиси молибдена углеродом.
Промышленное применение молибдена относится к началу 20 в. (произ-во молибденовых сталей).
Физические свойства молибдена
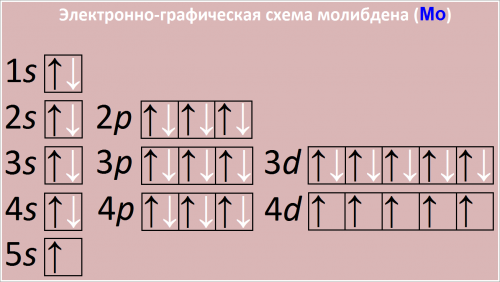
Полная электронная формула атома молибдена в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s1
Сокращенная электронная конфигурация Mo:
[Kr] 4d5 5s1
Атомная теплоемкость (т-ра 25° С) 5,867 и (т-ра 1200° С) 7,430 кал/г-атом · град.
Удельная теплоемкость изменяется соответственно от 0,061 до 0,077 кал/г · град.
Коэфф. теплопроводности (в интервале т-р 927 —1627° С) от 0,259 до 0,159 кал/см · сек · град, при т-ре — 183°С равен 0,438 кал/см · сек · град.
Средний температурный коэфф. линейного расширения в интервале т-р 0° С — температура плавления составляет αср•10 6 = 5,05 + 0,31 · 10-3 t + 0,36 · 10-6 t2.
Удельное электрическое сопротивление увеличивается от 5,20 · 10-6 (т-ра 20° С) до 81,40 · 10-6 ом · см (т-ра 2620° С), температурный коэфф. электр. сопротивления (в интервале т-р 20—2620° С) 0,00479.
Температура перехода молибдена в сверхпроводящее состояние 0,90—0,98 К.
Работа выхода электронов 4,15—4,37 эв. Термоэдс от 10 (т-ра 480° С) до 30 мв (т-ра 1030° С).
Молибден парамагнитен.
Механические свойства молибдена зависят от предшествующей мех. и термической обработки и чистоты металла. Молибден высокой чистоты с низким содержанием примесей внедрения пластичен.
Прочность на растяжение увеличивается с возрастанием степени деформации от 52,5 кгс/мм2 для прутка диаметром 6,2 мм до 250 кгс/мм2 для проволоки диаметром 0,02 мм.
Прочность на растяжение: спеченного штабика (0,02% О2; 0,04% N2) — 50 100 кгс/мм2; слитка дуговой плавки (0,003% О2 0,001% N2; 0,0003% Н2) — 57,1 кгс/мм2.
Монокристаллического М. (0,0008% 02; 0,0006% N2; 0,0004% Н2) — 31 кгс/мм2, микротвердость соответственно 150—200; 170—200 и 160—170 кгс/мм2.
Твердость поли 189,5;20 и 1857° С равна соответственно 373; 159,2 и 12,6 кгс/мм2. Модуль норм, упругости понижается от 32 300 кгс/мм2 при комнатной т-ре до 28 040 кгс/мм2 при т-ре 870° С.
Коэфф. сжимаемости 0,347 · 10-6 см2/кг.
Переходные металлы V, VI групп периодической системы и титан образуют с молибденом непрерывный ряд твердых растворов, металлы VII, VIII групп, цирконий и гафний — металлические соединения.
Химические свойства молибдена
С переходными элементами III группы соединений или образования твердых растворов не наблюдается.
Диаграммы состояния М. с элементами I, II групп и непереходными металлами III группы не изучены, иногда указывается на отсутствие соединений или растворимости металлов.
Бериллий, цинк, бор, алюминий, галлий и германий образуют с молибденом соединения. Неметаллические элементы IV—VI групп также образуют соединения, наиболее важные из них — карбиды, силициды, нитриды и сульфиды.
При низкой т-ре молибден не взаимодействует с воздухом и кислородом, окисление начинается при т-ре 400° С и сильно зависит от зернистости порошка.
Реагирует с галогенами, придем чем меньше их атомная масса, тем взаимодействие сильнее. Фтор действует на молибден при комнатной т-ре, йод не взаимодействует даже при нагреве.
Изотопы
Природный молибден — смесь стабильных изотопов 92Мо (15,86%), 94Мо (9,12%), 95Мо (15,70)%, 96Мо (16,50%), 97Мо (9,45%), 98Мо (23,75%) и 100Мо (9,62%).
Получены 10 радиоактивных изотопов.
Молибден содержащие минералы
Содержание его в земной коре 1,1 · 10-4 %. Известны около 20 минералов молибдена. Из них наиболее часто встречаются в природе: молибденит, повеллит СаМоO4, молибдит Fe2 (МоO4)3 х nН2O, вульфенит РbМoО4, молибдошеелит Са (W, Мо)O4.
Чиллагит Рb(Мо, W)O4, кехлинит Bi2(МоO4)O2, линдгренит Сu (МоO4)2(ОН)2, ильземанит МоO3·SO3·5Н2O, ураномолибдат UO2 · UО3 · 2МоО3, эозит 3РbО х V2O4 · MoO3; белонезит MgMoO4 и патерзит СоМоO4. Пром. значение имеют молибденит, повеллит, молибдит и вульфенит.
Кристаллическая решетка молибдена объемноцентрированная кубическая с периодом а = 3,1466 А.
Атомный радиус 1,39 А (для координационного числа 12); ионный радиус Мо+4 составляет 0,68 А, ионный радиус Мо+6 равен 0,62 А.
Окисление молибдена кислотами щелочами
Соляная и серная к-ты в холодном состоянии не действуют на молибден, реакция начинается при т-ре 110° С. Азотная к-та и «царская водка» действуют уже в холодном состоянии, быстро — при нагревании.
Гидроокиси натрия и калия в холодном состоянии не реагируют с молибденом, в расплавленном состоянии растворяют его на воздухе медленно, при наличии окислителей — быстро.
В большинстве пром. месторождений молибдена содержание молибденита не превышает 1%. Руды молибдена обогащают главным образом флотацией, доводя Содержание MoS2 до 85—90%.
Разложение молибденовых концентратов может быть осуществлено окислением кислородом под давлением в щелочном растворе, азотной кислотой, растворами гипохлорита натрия, хлорированием и др.
Основной промышленный способ— окислительный обжиг. Огарок, содержащий МоО3, служит исходным материалом для выплавки ферромолибдене.
Молибден реагирует с кислотами: растворяется в «царской водке», горячих концентрированных соляной, серной и азотной, а также в окислительно щелочных расплавах (например, в смеси NaOH И КОН).
Вода медленно окисляет порошкообразный молибден в сложную смесь гидратированных оксидов — «молибденовая синь»
С неметаллами молибден и реагирует при значительном нагревании, образуя прочные карбиды, силициды, сульфиды, галогениды и целый ряд оксидов , самыми устойчивыми из которых являются высшие МоО3 .
Им соответствуют соль Na2MoО4 молибденовой кислоты . В кислой среде анионы этих солей способны к конденсации, и образуется ряд полимолибденовых кислот.
Состав растворов молибдатов и вольфраматов сильно зависит от pH среды .
Получение молибдена
Молибден в чистом виде из руд получить очень трудно. Поэтому чаше всего из полиметаллических или молибдено- и вольфрамово-железных руд выделяют ферромолибден — основное сырье для металлургической промышленности.
Анализ молибден содержащие минералы производят в специализированных предприятиях с помощью органического анализа.
Для получения чистых металлов его подвергают обжигу до оксидов или хлоридов и последующему восстановлению.
Чистую трехокись МоО3 получают возгонкой или гидрометаллургическим способом, обрабатывая огарок аммиаком, едким натром или содой.
Трехокись восстанавливают до металла водородом, углеродом, углеродсодержащими газами или металлотермическим восстановлением (алюминием, кремнием).
В промышленном произ-ве применяют в основном восстановление водородом, получая молибденовый порошок, к-рый превращают в компактные заготовки методами порошковой металлургии или плавкой.
Молибден получают также термической диссоциацией дисульфида молибдена, термической диссоциацией и восстановлением галогенидов молибдена, электролизом расплавленных сред и др.
Молибден производят в виде штабиков, проволоки, пластин, лент, фольги, жести и слитков.
Применение молибдена
Около 75% производимого молибдена используют для легирования чугуна и сталей (конструкционных, инструментальных, быстрорежущих, нержавеющих, для штампов, антикоррозионных и жаропрочных).
Молибден и молибдена сплавы применяют в электровакуумной, авиационной и ракетной технике, в производстве рентгеновских трубок, нагревательных элементов высокотемпературных печей.
Покрытие молибденом (см. Молибденирование) поверхности металлических изделий повышает твердость, поверхностную прочность, коррозионную стойкость и др.
Из соединений молибдена в технике используют дисульфид молибдена MoS2 — эффективный молибденовая смазка для трущихся частей механизмов (область использования от — 40 до 350° С).
Молибдат Na2MoО4 — в произ-ве красок и лаков; трисульфида MoS3, двуокись МоО2 и трехокись МоО3 т— катализаторы в хим. и нефтяной пром-сти, в частности при гидрировании углей и нефти.
Применение молибдена зависит от сферы его получения.
Молибден в медицине
Молибдену принадлежит видная роль в ряде биологических процессов. Он относится к числу микроэлементов, обладающих специфическим действием на растительные и животные организмы.
Спектральными исследованиями обнаружено его присутствие в клетках головного мозга млекопитающих.
В азотфиксирующих бактериях он, по-видимому, входит в состав ферментов, обеспечивающих связывание атмосферного азота.
Повышение молибдена в почвах вредно влияет па состояние травоядных животных. Молибден один из виновников подагры.
Он входит в состав фермента ксантиноксидазы, ускоряющей азотистый (в частности, пуриновый обмен) веществ.
В результате распада пуринов образуется мочевая кислота.
Если этой кислоты слишком много , почки не успевают выводить из организма, то соли ее скапливаются в суставах и мышечных сухожилиях, вызывая подагрическую боль.
Одно из соединений молибдена — молибдат аммония нашел в медицине специфическое применение.
Он губителен для микроорганизмов и его используют в качестве дезинфицирующего средства. Им пропитывали ткани, чтобы уберечь их от гниения и продлить срок службы.
Потом оказалось, что это соединение может служить основой для получения тканей различных расцветок.
Так из медицины молибдат аммония перекочевал в текстильную и лакокрасочную промышленность.
Часто задаваемые вопросы и ответы о молибдене?
Какая температура плавления молибдена?
Молибден является тугоплавким металлом с температурой плавления 2620 °C и температурой кипения 4639 °C.
Где применяется молибден?
Чистый монокристаллический молибден используется для производства зеркал для мощных газодинамических лазеров.
Теллурид молибдена является очень хорошим термоэлектрическим материалом для производства термоэлектрогенераторов (термо-ЭДС 780 мкВ/К).
Трёхокись молибдена (молибденовый ангидрид) широко применяется в качестве положительного электрода в литиевых источниках тока.
Какая у молибдена степень окисления?
Атомы молибдена в соединениях имеют степени окисления +2, +3, +4, +5,+6. Степень окисления — это условный заряд атома в соединении: связь в молекуле между атомами основана на разделении электронов, таким образом.
Если у атома виртуально увеличивается заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается, то степень окисления положительная.
Где в России добывают молибден?
В России молибден выпускают на Сорском ферромолибденовом заводе. Более 7 % от мировых запасов молибдена расположены в Армении, причем 90 % из них сосредоточены в Каджаранском медно-молибденовом месторождении.
Что такое молибден в породах?
Молибден в породах находится в следующих формах: молибдатной и сульфидной в виде микроскопических и субмикроскопических выделений, изоморфной и рассеянной (в породообразующих минералах).
Молибден обладает большим сродством с серой, чем с кислородом, и в рудных телах образуется сульфид четырёхвалентного молибдена — молибденит.
Какие основные свойства молибдена?
Рассматривая различные применения молибдена в качестве металла, наиболее важными свойствами следует считать плотность, температуру плавления, электрическое сопротивление, коэффициент линейного расширения.
Что такое молибден с вольфрамом?
МВ — сплав молибдена с вольфрамом. для молибдена характерна высокая коррозионная стойкость. Данный металл устойчив в большей части щелочных растворов, а также в серной, соляной и плавиковой кислотах при разных температурах и концентрациях.
Что такое чистый молибден?
Чистый молибден в 1817 году получил Й. Берцелиус восстановлением оксида водородом. Название происходит от др.-греч. μόλυβδος, означающего « свинец ».
Оно дано из-за внешнего сходства молибденита (MoS2 ), минерала, из которого впервые удалось выделить оксид молибдена, со свинцовым блеском (PbS).



Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.