Свойства элементов вольфрама и молибдена
Вольфрам и молибден — переходные элементы пятого и шестого периодов, размещенные в VI группе Периодической системы. Конфигурация атомов во внешних орбиталях — d5s1 (Mo), d5s2 (W). Обоим элементам свойственна максимальная степень окисления (VI) и ее устойчивость при малой вероятности существования простых катионов. Более низкие степени окисления наблюдаются преимущественно в условиях стабилизации комплексообразованием, возможность которого из-за малого заполнения d-орбитали обширна.
Простые соединения Mo (V) и W (V) на воздухе не устойчивы, а комплексные — стойки; Mo (III) и W (III) в виде катионов не известны.
Молибдаты и вольфраматы типа MeI2MoO4 и MeI2WO4 (где Me — щелочной металл, аммоний, магний или таллий) в воде растворимы, а прочие — нерастворимы.
Металлы при обычных температурах стойки в атмосфере и кислороде, а нагретые выше 500° С сгорают в трехокиси МоO3 и WO3, соответственно белого и желто-зеленого цвета. Азотная кислота пассивирует вольфрам и молибден, а в смеси с плавиковой энергично их растворяет. Серная, соляная кислоты и растворы щелочей на металлы не действуют.
Окислы МoО3 и WO3 называют ангидридами молибденовой и вольфрамовой кислот; хотя при действии воды последние не получаются. МоО3 плавится при 795° С, кипит при 1155° С. WO3 — неплавок. Частично восстанавливая ангидриды водородом, можно получить Мo2О5, МoО2, WO2 и ряд нестехиометри-ческих окислов.
Сульфиды молибдена известны в степенях окисления (III), (IV), (V) и (VI), в том числе природный молибденит M0S2. Темно-коричневый MoS3 осаждается из растворов молибдатов под действием сероводорода. С сульфидами щелочных металлов он дает растворимые тиосоли — Me12MoS4 вновь выделяющие этот сульфид при подкислении.
Сульфид вольфрама сероводородом не осаждается, но при действии на растворы вольфраматов сернистого аммония получаются растворимые окситиовольфраматы с анионом WOnS24-n—, выделяющие при подкислении осадок WS3.
Поликислоты молибдена и вольфрама имеют изополианио-ны, содержащие, помимо элемента, только водород и кислород, либо гетерополианионы, включающие еще один—два элемент та, в частности фосфор, мышьяк и кремний. Из первых типичны парамолибдаты [М07О24]6- и паравольфраматы [HW6O21]5-.
Димолибдаты, выпадающие при подкислении растворов до рН=5÷6, вероятно, смеси нормальных молибдатов и полимо-либдатов Na2O • 2МоО3, не содержащих, однако, Мо2О27—, а представляющие собой полимеры.
Изополивольфраматы сходны с подобными соединениями молибдена, наиболее обычен из них паравольфрамат [W12O41]10-, образующийся по такой схеме:
Галогениды типов MeCl2, MeCl4, MeF4 (MeCl5), MeF6, а для молибдена также MoCl3 и MoF3, получаются в виде газов прямым хлорированием или фторированием металлов при высоких температурах. Эти соединения преимущественно ковалентного типа в конденсированном состоянии растворимы в CS2, СС4, спирте, эфире, а водой гидролизуются.
Металлы при нагревании с соответствующими элементами дают твердые огнеупорные бориды, нитриды, карбиды и силициды. Для реакции необходимы тонкое измельчение, иногда — брикетирование и высокие температуры.
Статья на тему Свойства элементов вольфрама и молибдена

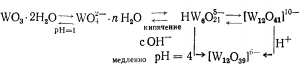
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.