Гидроксиды (гидроокиси) это неорганические сложные вещества, которые гидроксильную группу — ОН.
В химии почти все химические вещества образуют гидроксиды, поэтому часто могут встречаются в природе в виде минералов.
Примером может служить гидроксид железа (II) амакинита, или гидроксид алюминия Al(OH)3 гиббсит.
Все гидроокиси можно разделить на две группы:
- Растворимые (например NaOH, KOH)
- Нерастворимые (например Cu(OH)2, Fe(OH)3)
И на три по числу гидроксильных групп:
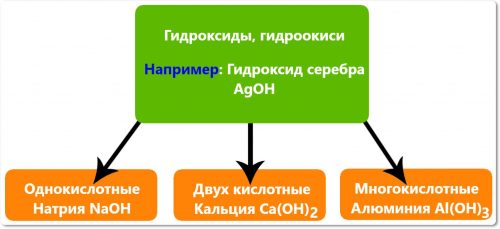
- Однокислотные.
- Двух кислотные.
- Многокислотные.
Гидроокиси (гидроксиды). Состав и свойства
Гидроокислами, или основаниями, называются электролиты, диссоциирующие в водных растворах с образованием в качестве катионов ионов металла, а в качестве анионов — только ионов гидроксила.
Например:
NaOH = Na+ + ОН—
Са(ОН)2 = Са2+ + 2ОН—
В табл. 1 и 2 приводится классификация оснований по числу гидроксильных групп и по растворимости в воде.
Классификация оснований по числу гидроксильных групп
Однокислотные:
- Гидроксид натрия NaOH.
- Гидроксид калия КОН.
- Гидроксид серебра AgOH.
Двух кислотные:
- Кальция Ca(OH)2.
- Меди Cu(OH)2.
- Бария Ва(ОН)2.
Многокислотные:
- Алюминия Al(OH)3.
- Железа Fe(OH)3.
Классификация оснований по растворимости в воде
Растворимые
NaOH, Са(ОН)2, КОН, Ва(ОН)2 и другие основания,
образованные металлами главных подгрупп I и II групп, кроме Ве(ОН)2.
Нерастворимые
Cu(OH)2, Fe(OH)3, Fe(OH)2 и др.
Растворимые основания являются сильными электролитами и носят название сильных оснований.
Гидроокиси металлов главной подгруппы I группы являются наиболее сильными и в некоторых случаях носят название едких щелочей, например едкий натр NaOH, едкое кали КОН.
Изредка встречается название едкий барит Ва(ОН)2, несмотря на то что барий — металл II группы.
Обычно основания носят общие названия гидроокисей, или гидроксидов, например гидроокись кальция (гидроксид кальция), гидроокись лития (гидроксид лития).
Если металл может иметь в соединениях разную валентность, то она проставляется рядом в скобках римской цифрой, например гидроокись меди (II), гидроокись железа (III) и т. д.
➡️ 90. Пользуясь периодической системой, напишите формулы следующих оснований и укажите, к какой группе по числу гидроксил-ионов и по растворимости они относятся:
а) гидроокись лития;
б) гидроокись стронция;
в) гидроокись галлия;
г) гидроокись алюминия;
д) гидроокись калия;
е) гидроокись меди (II),
ж) гидроокись железа (III). (См. Ответ)
Основания
Основания являются твердыми веществами. Щелочи — это кристаллические вещества белого цвета, химически весьма стойкие, поэтому в хорошо закупоренном виде они могут длительное время храниться в лаборатории.
Едкие щелочи при попадании на кожу могут причинить сильные ожоги, поэтому кристаллические щелочи следует брать не руками, а только щипцами или пинцетом.
При попадании на кожу раствора щелочи необходимо прежде всего смыть раствор до исчезновения ощущения мылкости большим количеством воды, а затем нейтрализовать раствором борной кислоты.
Нерастворимые основания являются твердыми веществами, различно окрашенными.
При хранении нерастворимые основания довольно быстро разлагаются, поэтому в лаборатории их не хранят, а, как правило, используют свежеприготовленные.
Химические свойства щелочей
Химические свойства щелочей более разнообразны, чем нерастворимых оснований. Для сравнения проведем между ними параллель.
Растворимые основания
1. Растворимые основания действуют на индикаторы. «Индикатор» в переводе значит «указатель» «определитель».
С помощью вещества-индикатора определяют, какое вещество имеется в избытке в данном растворе, — кислота или щелочь. Изменение цвета индикатора дает ответ на этот вопрос.
Здесь будем говорить о трех индикаторах:
- Лакмус, который в нейтральной среде (вода) имеет фиолетовую окраску.
- Фенолфталеине (в нейтральной среде бесцветен).
- Метиловом оранжевом (в нейтральной среде желтый).
В щелочах лакмус синеет, фенолфталеин становится малиновым, а метиловый оранжевый остается желтым.
Однозначное действие на индикаторы всех растворимых оснований объясняется наличием в их растворах большой концентрации гидроксил-иона ОН—.
Такие растворы обычно называют щелочными.
Взаимодействие с кислотными окислами
Растворимые основания (условимся в дальнейшем именовать их щелочами) могут вступать во взаимодействие с кислотными окислами.
Примером является реакция известковой воды при пропускании через нее двуокиси углерода:
Са(ОН)2 + СО2 = CaCО3 + Н2О
Са2+ + 2ОН— + СО2 = СаСО3 + Н2О
Это свойство рассматривалось нами при изучении химических свойств кислотных окислов.
Взаимодействие с кислотами
Все основания могут вступать в реакцию с кислотами. При этом образуются соль и вода.
Реакция между основаниями и кислотами, в процессе которой образуются нейтральная соль и вода, называется реакцией нейтрализации:
NaOH + HNO3 = NaNО3 + H2О
Na+ + ОН— + H+ + NO3— = Na+ + NO3— + H2O
H+ + OH— = H2О
Поскольку щелочи и кислоты являются веществами главным образом бесцветными, а в процессе реакции образуются также бесцветные вещества.
То реакцию между ними следует проводить в присутствии индикатора, который поможет обнаружить наличие реакции.
На этой реакции в количественном анализе основан метод нейтрализации.
Взаимодействие с растворимыми солями
Щелочи могут реагировать с растворимыми солями. При этом образуются новая соль и нерастворимое основание:
FeCl3 + 3NaOH = Fe(OH)3↓ + 3NaCl
Fe3+ + 3Cl— + 3Na+ + ЗОН— = Fe(OH)3 + 3Na+ + 3Cl—
Fe3+ + 3ОН— = Fe(OH)3
Удобнее для реакции со щелочью брать соль, в состав которой входит металл, образующий нерастворимое основание.
В противном случае реакция будет обратимой.
Можно подобрать и такую реакцию, в которой в осадок выпадает соль.
Например:
Са(ОН)2 + Na2CO3 = CaCO3 + 2NaOH
Са2+ + 2OН— + 2Na+ + CO23— = CaCO3 + 2Na+ + 2OH—
Ca2+ + CO23— = CaCO3
Разложение на основной окисел и воду
Многие основания, особенно нерастворимые, могут разлагаться на основной окисел и воду:
Ca(OH)2 = СаО + Н2О
Растворимые основания разлагаются — только при сильном прокаливании.
Нерастворимые основания
1. Нерастворимые основания на индикаторы не действуют, так как в растворе практически не диссоциируют и не создают избытка гидроксил-ионов.
2. Нерастворимые основания реагируют с кислотными окислами лишь крайне медленно и с трудом.
3. Все основания могут вступать в реакцию с кислотами. При этом образуются соль и вода.
Реакция между основаниями и кислотами, в процессе которой образуются нейтральная соль и вода, называется реакцией нейтрализации:
Cu(OH)2 + 2HCl = CuCl2 + 2H2O
Cu(OH)2 + 2Н+ + 2Cl— = Сu2+ +2Сl— + 2H2O
Сu(OН)2 + 2Н+ = Сu2+ + 2Н2O
4. Нерастворимые основания под действием кислот растворяются. Это является достаточно ярким показателем наличия реакции.
5. Нерастворимые основания с солями не реагируют.
6. Многие основания, особенно нерастворимые, могут разлагаться на основной окисел и воду:
Cu(OH)2 = CuO + H2O
7. Нерастворимые основания постепенно разлагаются даже при обычных условиях.
Что касается едких щелочей NaOH, КОН и др., то они практически совсем не подвержены разложению.
➡️ 91. С какими из перечисленных веществ будет реагировать едкое кали:
а) хлорид цинка,
б) окись кальция,
в) окись серы (VI),
г) кремниевая кислота,
д) карбонат магния,
е) карбонат натрия;
ж) нитрат меди (II).
Подтвердите свой вывод уравнениями реакций в молекулярной и ионных формах. (См. Ответ)
92. Рассчитайте, сколько гидроокиси кальция вступит в реакцию с 280 г азотной кислоты, если она содержит 10% примесей. (Это новый тип химических задач, в которых исходное вещество содержит примеси.)
93. Какой объем двуокиси углерода израсходуется на реакцию с 10 г едкого натра, содержащего 20% примесей?
94. Сколько соли получится при реакции 570 г гидроокиси бария с серной кислотой, если гидроокись бария содержит 10% примесей? (См. Ответ)
Получение оснований
Растворимых
1. При непосредственном взаимодействии металла (Na, К) с водой
2Na + 2H2O = 2NaOH + H2
2Na + 2H2O = 2Na+ + 2OH—+ H2
2. При взаимодействии основного окисла с водой:
СаО + H2О = Са(ОН)2
3. Чаше всего щелочи получают в технике из солей (например, таких, как NaCl, KCI) разложением их растворов электрическим током.
4. Как растворимые могут быть получены из растворимых солей соответствующих металлов действием едких щелочей:
K2SO4 + Ba(OH)2 = 2KOH + BaSO4
2K+ + SO24— + Ba2+ + 2OH— = BaSO4 + 2K+ +2OH—
Ba2+ + SO24— = BaSO4
Нерастворимых
Нерастворимые основания первыми тремя способами получены быть не могут.
- Нерастворимые основания могут быть получены из растворимых солей соответствующих металлов действием едких щелочей:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
Cu2+ + SO24— + 2Na+ + 2OH— = Cu(OH)2 + 2Na+ + SO24—
Cu2+ + 2OH— = Cu(OH)2
Это единственный способ получения нерастворимых оснований.
➡️ 95. Предложите все возможные способы получения гидроокиси кальция. (См. Ответ)
96. Каким образом можно получить гидроокись кальция, исходя из карбоната кальция?
97. Имеются медь, кислород, соляная кислота, вода, металлический натрий. Каким образом, пользуясь только этими веществами, можно получить гидроокись меди?
98. В четырех колбах находятся растворы:
- в одной — азотной кислоты,
- в другой — гидроокиси натрия,
- в третьей — гидроокиси бария,
- в четвертой — вода.
Как определить, в какой колбе какой раствор? Какие реактивы для этого требуются?
99. Сколько окиси кальция потребуется для получения 37 г гидроокиси, если окись содержит 20% примесей? (См. Ответ)
Быстрые ответы?
Свое название «Едкие щёлочи» они получи от свойств разъедать кожу, образуя при этом (химические ожоги).
Классифицируют на растворимые и нерастворимые.
Например растворимые гидроксид натрия NaOH, не растворимые меди Cu(OH)2.
А также однокислотные: NaOH. Двух кислотные: Са(ОН)2. Многокислотные: Al(OH)3.
1. Основные (основания).
2. Амфотерные.
3. Кислотные.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.