Германий это химический элемент, простое вещество находиться в 14 группе 4 периода периодической системы химических элементов, имеет формулу Ge и атомный номер 32.
В природе встречается в виде соединений с другими элементами сульфосоли:
Германит Cu2(Cu, Fe, Ge, Zn)2 (S, As)4 (6—10 % Ge), аргиродит Ag8GeS6 (3,6—7 % Ge), конфильдит Ag8(Sn, Ge) S6 (до 2 % Ge) и др. редкие минералы (ультрабазит, ранерит, франкеит), очень редко образует собственный минерал.

Что такое германий
(Germanium; от лат. Germania — Германия), Ge — химический элемент 14-й группы (устаревшая классификация: IVА группы) 4 периода периодической системы элементов.
Атомный номер 32, атомная масса 72,59.
Серебристо-серое вещество с металлическим блеском. В хим. соединениях проявляет степени окисления + 2 и +4.
Соединения со степенью окисления +4 более стойки.
Существование и св-ва германия (под названием «экасилиций») предсказал в 1871 рус ученый Д. И. Менделеев.
Однако лишь в 1886 нем. химик К. Винклер обнаружил в минерале аргиродите неизвестный элемент, св-ва к-рого совпадали со св-вами «экасилиция».
Начало пром. произ-ва германий относится к 40-м гг. 20 в., когда он получил применение в качестве полупроводникового материала. Содержание германия в земной коре (1—2) 10-4 %.
Германий относится к рассеянным элементам и редко встречается в виде собственных минералов.
Известно семь минералов, в к-рых его концентрация больше 1 %, среди них:
- Германит Cu2 (Сu, Ge, Ga, Fe, Zn)2 • (S, As)4X X (6,2-10,2% Ge).
- Рениерит (Cu, Fe)2 (Cu, Fe, Ge, Ga, Zn)2 X X (S, As)4 (5,46-7,80% Ge).
- Аргиродит Ag8GeS6 (3/55—6,93% Ge).
Германий накапливается также в каустобиолитах (гумусовых углях, горючих сланцах, нефти).
Стойкая при обычных условиях кристаллическая модификация германия имеет кубическую структуру типа алмаза, с периодом а = 5,65753 A (Gel).
Физические свойства
Плотность германия (т-ра 25° С) 5,3234 г/см3, tпл 937,2° С; tкип 2852° С; теплота плавления 104,7 кал/г, теплота сублимации 1251 кал/г, теплоемкость (т-ра 25° С) 0,077 кал/г • град.
Коэфф. теплопроводности, (т-ра 0° С) 0,145 кал/см • сек • град, температурный коэфф. линейного расширения (т-ра 0 — 260° С),5,8 х 10-6 град-1.
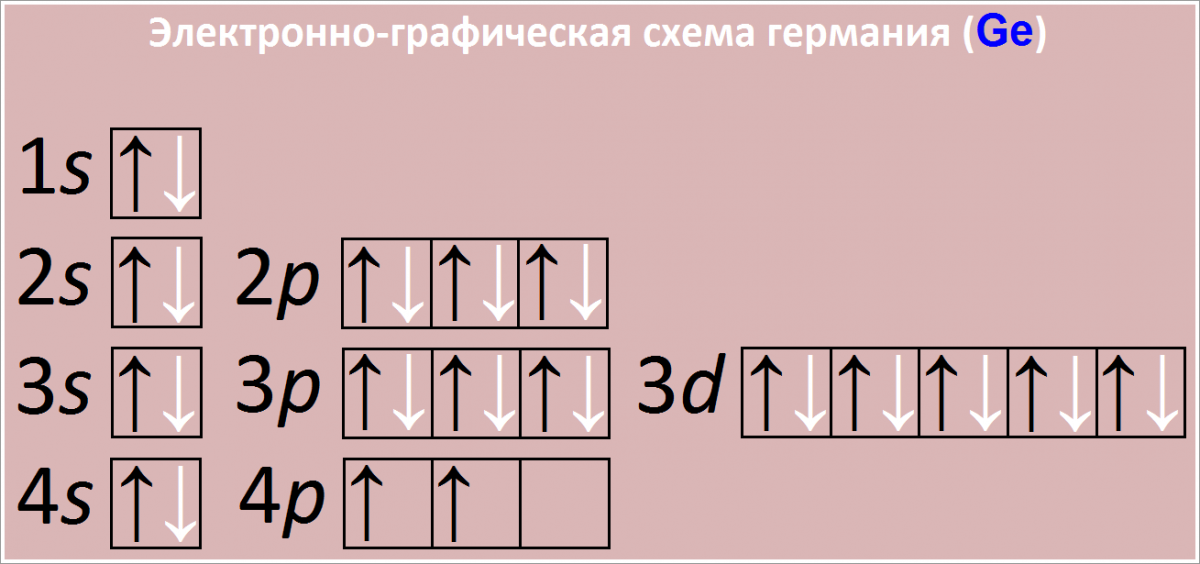
Полная электронная формула атома германия в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p2
При плавлении германий уменьшается в объеме (примерно на 5,6%), плотность его увеличивается на 4%.
При высоком давлении алмазо-подобная модификация.
Германий претерпевает полиморфные превращения, образуя кристаллические модификации:
- Тетрагональную структуру типа B-Sn (GeII).
- Объемноцентрированную тетрагональную структуру с периодами α = 5,93 А, с = 6,98 A (GeIII).
- Объемноцентрированную кубическую структуру с периодом α = 6,92 A(GeIV).
Эти модификации по сравнению с GeI отличаются большими плотностью и электропроводностью.
Аморфный германий может быть получен в виде пленок (толщиной примерно 10 — 3 см) при конденсации пара. Плотность его меньше плотности кристаллического.
Структура энергетических зон в кристалле обусловливает его полупроводниковые св-ва.
Ширина запрещенной зоны равна 0,785 эв (т-ра 0 К), удельное электрическое сопротивление (т-ра 20° С) 60 ом · см и с повышением т-ры значительно понижается по экспоненциальному закону.
Примеси придают германию т. н. примесную проводимость электронного (примеси мышьяка, сурьмы, фосфора) или дырочного (примеси галлия, алюминия, индия) типа.
Подвижность носителей зарядов в Г. (т-ра 25° С) для электронов — около 3600 см2/в сек, для дырок — 1700 см2/в · сек, собственная концентрация носителей зарядов (т-ра 20° С) 2,5 · 10 13 см-3. Г. диамагнитен.
При плавлении переходит в металлическое состояние.
Германий очень хрупок, твердость его по Моосу 6,0, микротвердость 385 кгс/мм2, предел прочности на сжатие (т-ра 20° С) 690 кгс/см2.
С повышением т-ры твердость снижается, выше т-ры 650° С он становится пластичным, поддается мех. обработке.
Германий практически инертен к воздуху, кислороду и к неокисляющим электролитам (если нет растворенного кислорода) при т-ре до 100° С.
Химические свойства германия
Стойкий к действию соляной и разбавленной серной к-т; медленно растворяется в концентрированных серной и азотной к-тах при нагревании.
Образующаяся при этом пленка двуокиси замедляет растворение, хорошо растворяется в «царской водке».
В растворах гипохлоритов или гидроокисей щелочных металлов (при наличии перекиси водорода), в расплавах щелочей, перекисей, нитратов и карбонатов щелочных металлов.
Выше т-ры 600° С окисляется на воздухе и в токе кислорода, образуя с кислородом окись GeO и двуокись (GeО2).
Окись германия темно-серый порошок, возгоняющийся при т-ре 710° С, незначительно растворяется в воде с образованием слабой германитной к-ты (H2GeO2).
Соли к-рой (германиты) малостойки. В к-тах GeO легко растворяется с образованием солей двухвалентного германия.
Изотопы
Природный германий состоит из четырех стабильных изотопов с массовыми числами 70Ge (20,55%), 72 (27,37%), 73Ge (7, 67%) и 74Ge (36,74%).
И одного радиоактивного изотопа с массовым числом 76Ge (7,67%) и периодом полураспада 2 • 106 лет.
Искусственно (с помощью различных ядерных реакций) получено много радиоактивных изотопов; наибольшее значение имеет изотоп 71Ge с периодом полураспада 11,4 дня.
Двуокись германия
Двуокись германия — порошок белого цвета, существует в нескольких полиморфных модификациях, сильно различающихся по хим. св-вам:
- Гексагональная модификация двуокиси сравнительно хорошо растворяется в воде (4,53 zU при т-ре 25° С), растворах щелочей и кислот.
- Тетрагональная модификация практически нерастворима в воде и инертна к кислотам.
Растворяясь в щелочах, двуокись и ее гидрат образуют соли метагерманатной (H2GeO3) и ортогерманатной (H4GeO4) к-т — германаты.
Германаты щелочных металлов растворяются в воде, остальные германаты практически нерастворимы; свежеосажденные растворяются в минеральных к-тах.
Германий легко соединяется с галогенами, образуя при нагревании (около т-ры 250° С) соответствующие тетрагалогениды — не солеобразные соединения, легко гидролизующиеся водой.
Известны сульфиды — темно-коричневый (GeS) и белый (GeS2).
Соединения германия с другими элементами
Для германия характерны соединения с азотом — коричневый нитрид (Ge3N4) и черный нитрид (Ge3N2), отличающийся меньшей хим. стойкостью.
С фосфором германий образует малостойкий фосфид (GeP) черного цвета. С углеродом не взаимодействует и не сплавляется, с кремнием образует непрерывный ряд твердых растворов.
Для германий, как аналога углерода и кремния, характерна способность образовывать германоводороды типа GenH2n + 2 (германы).
А также твердые соединения типов GeH и GeH2 (гермены).
Германий образует металлические соединения (германиды) и сплавы со мн. металлами.
Получение
Извлечение германия из сырья заключается в получении богатого германиевого концентрата, а из него —вещества высокой чистоты.
В пром. масштабе германий получают из тетрахлорида, используя при очистке его высокую летучесть (для выделения из концентрата).
Малую растворимость в концентрированной соляной к-те и высокую растворимость в органических растворителях (для очистки от примесей).
Часто для обогащения используют высокую летучесть низших сульфида и окисла, к-рые легко сублимируются.
Для получения полупроводникового германий применяют направленную кристаллизацию и зонную перекристаллизацию.
Монокристаллический германий получают вытягиванием из расплава. В процессе выращивания легируют спец. добавками, регулируя те или иные св-ва монокристалла.
Германий поставляют в виде слитков длиной 380 — 660 мм и поперечным сечением до 6,5 см2.
Германий это простое вещество серо-белого цвета и имеет твердые характеристики как для метала .
Содержание в земной коре 7.10 — 4% по массе. относится к рассеянным элементам, из за сваей реакционной способности к окислению в свободном состоянии как чистый метал не встречается.
Нахождение германия в природе
Германий — один из трёх химических элементов , предсказанных Д.И. Менделеевым на основании их положения в периодической системы (1871 г ).
Он относится к редким рассеянным элементам.
В настоящее время основными источниками промышленного получения германия являются:
- Отходы цинкового производства.
- Коксования углей.
- Зола некоторых некоторых видов углей.
- В примесях силикатов.
- Осадочных породах железа.
- В никелевых и вольфрамовый рудах.
- Торфе , нефти.
- Геотермальных водах и в некоторых водорослях.
Минералы содержащие германий
- Плюмбогерматит (PbGeGa)2SO4(OH)2 + H2O содержание до 8.18 %
- Германит Cu(GeFeGa)(SAs)4 содержит от 6 до 10% германия.
- Яргиродит AgGeS6 содержит от 3.65 до 6.93 % германия.
- Рениерит Cu3(FeGeZn)(SAs)4 содержит от 5.5 до 7.8% германия.
В некоторых странах получение германия является побочным продуктом переработки некоторых руд таких как цинк-свинец-медь.
Также германий получают в производстве кокса, а также в золе бурого угля с содержанием от 0.0005 до 0.3% и в золе каменных углей с содержанием от 0.001 до 1 -2 %.
Окисление и соединения германия
Германий как металл очень устойчив к действию кислорода воздуха, кислорода, воды некоторых кислот, разбавленной серной и соляной кислоты.
Но сконцентрированной серной кислотой реагирует очень медленно.
Германий реагирует с азотной кислотой HNO3 и царской водкой, медленно реагирует едкими щелочами с образованием соли германата, но при добавлении перекиси водорода H2O2реакция протекает очень быстро.
При воздействии высоких температур свыше 700 °С германий легко окисляется на воздухе с образованием GeO2, легко вступает в реакцию с галогенам, получая при этом тетрагалогениты.
С водородом, кремнием, азотом и углеродом не вступает в реакцию.
Известны летучие соединения германия с характеристиками:
Германия гексагидрид -дигерман, Ge2H6— горючий газ, при длительном хранении на свету разлагается, окрашиваясь в желтый затем в коричневый цвет превращаясь в твёрдое вещество тёмно — коричневого цвета, разлагается водой и щелочами.
Германия тетрагидрид , моногерман — GeH4.
Применение германия
Германий применяют в радиоэлектронике и электротехнике как полупроводниковый материал для изготовления диодов и транзисторов.
Из него изготовляют:
- Линзы для приборов инфракрасной оптики.
- Дозиметры ядерных излучений.
- Анализаторы рентгеновской спектроскопии.
- Датчики, использующие эффект Холла.
- Преобразователи энергии радиоактивного распада в электрическую.
Германий используют в микроволновых аттенюаторах, термометрах сопротивления, эксплуатируемых при т-ре жидкого гелия.
Пленка германия нанесенная на рефлектор, отличается высокой отражательной способностью, хорошей коррозионной стойкостью.
Сплавы германия с другими элементами
Сплавы германия с некоторыми металлами, отличающиеся повышенной стойкостью к кислым агрессивным средам, используют в приборостроении, машиностроении и металлургии.
Сплавы германия с золотом образуют низкоплавкую эвтектику и расширяются при охлаждении.
Двуокись германия применяют для изготовления:
Спец. стекол, характеризующихся высоким коэфф. преломления и прозрачностью в инфракрасной части спектра.
- Стеклянных электродов.
- Термисторов.
- Эмалей и декоративных глазурей.
Германаты используют в качестве активаторов фосфоров и люминофоров.
Германий , как кремний и некоторые другие вещества, имеет свойства так называемых полупроводников.
Что такое полупроводники
Все вещества по их электропроводности делятся на три группы:
- Проводники
- Полупроводники
- Изоляторы (диэлектрики)
Удельная электропроводность металлов находиться в интервале 10В4 — 10В6 Ом • смВ-1, приведённое деление условно.
Однако можно указать принципиальное различие в электрофизических свойствах проводников и полупроводников.
У первых электропроводность с повышением температуры падает, у полупроводников возрастает.
При температуре, близкой к абсолютному нулю, полупроводники превращаются в изоляторы. Как известно, металлические проводники проявляют в таких условиях свойства сверхпроводимости.
Полупроводниками могут быть различные вещества. К ним относятся простые вещества: бор ,углерод (графит или алмаз) , кремний, германий , олово.
Собственная их электропроводность их электропроводность чрезвычайно мала и практически не может быть использована.
Полупроводники используются в виде ультра чистых веществ, к которым специально добавляют незначительное количество веществ.
Повышающих электропроводность полупроводниковой системы и придающих ей определённый характер требуемой данной конструкции.
Ультрачистый германий
В ультрачистом германии процент примесей не должен превышать в среднем 10 — 7% по массе.
Германий очень высокой чистоты для полупроводниковой техники получают, используя специальные методы.
Они заключаются в предварительном получении германия, максимально освобождённого от примесей химическими методами.
Затем германий доводят до ультрачистого состояния методом зонной плавки.
Применение ультрачистого германия
Германий как полупроводниковый материал, в основном используется в виде монокристаллов для изготовления диодов, транзисторов, фотодиодов и фоторезисторов.
Также из него делают линзы для приборов ИК- излучений, датчики Холла, в производстве термометров сопротивления которые эксплуатируются при температуре жидкого гелия He.
Сплавы германия с золотом обладают высокой прочностью и используются в ювелирном и зубопротезном деле.
Некоторые сплавы германия применяются как припои с золотом, кремнием и алюминием.
Так же германий нашёл широкое применение для производства оптоволокна все знают, что он служить для передачи информации с большими скоростями.
Что сразу стало использоваться в интернете, между городами и даже странами протянулись своеобразные информационные кабеля.
Литература
Ломашов И. П. Германий и кремний— важнейшие полупроводниковые материалы.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.