(Zirconium; от перс. заргун — золотистый), Zr — химический элемент 4-й группы, пятого периода (устаревшая классификация IV В группы) периодической системы элементов.
Атомный номер 40, атомная масса 91,22. Серебристо-белый металл.
В соединениях наиболее характерная степень окисления + 4.

История
Открыл (1789) нем. химик М. Клапрот в минерале цирконе. Металлический получил (1824) швед, химик Й. Я.
Берцелиус в виде черного порошка, загрязненного примесями.
В 1925 голл. ученый А. ван Аркель предложил способ йодидного рафинирования для получения чистейшего металла.
Физические свойства
В твердом состоянии цирконий — блестящий серебристо-белый металл.
Относятся цирконий к тяжелым металлам, он тугоплавок и в чистом состоянии обладает хорошими металлическими свойствами.
Полная электронная формула атома циркония в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d2 5s2
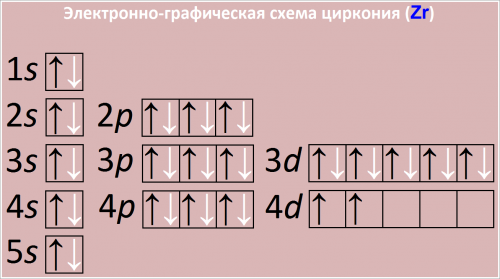
Рис. Электронно графическая схема циркония.
Цирконий активно взаимодействует с большинством элементов периодической системы. С разной степенью полноты исследовано (1977) 60 двойных, 110 тройных и 14 четверных систем.
Проведена классификация диаграмм состояния двойных систем на основе металла, выделено четыре осн. типа взаимодействия с др. элементами.
Цирконий существует в двух аллотропических модификациях:
- До т-ры 862° С — низкотемпературная — альфа-цирконий с гексагональной плотноупакованной кристаллической решеткой и периодами а = 3,2317 А, с = 5,1476 А.
- Выше т-ры 862° С — высокотемпературная — бета-цирконий с объемноцентрированной кубической решеткой и периодом а =3,59 А.
Плотность альфа-циркония (т-ра 20° С) 6,51 г/см3; tпл 1855° С; tкип 4330° С. Истинный коэфф. линейного расширения (т-ра 20° С, 0,0050% Hf) равен 5,89 х 10-6 град-1.
Объемный коэфф. линейного расширения при тех же условиях 17,68 х 10-6 град-1; коэфф. теплопроводности (т-ра 20—50° С) 0,050 кал/ см х сек х град.
Удельная теплоемкость (в интервале т-р 25—100° С) 0,0693 кал/г х град.
Удельное электрическое сопротивление в значительной степени определяется чистотой по примесям внедрения (кислороду, азоту, углероду), возрастая практически линейно при увеличении их содержания.
Удельное электр. сопротивление цирконий весьма высокой чистоты в отожженном состоянии 45-10 ом см.
Температурный коэфф. электрического сопротивления в интервале т-р 0 — 100° С равен 45 х 10-4 град-1.
Мех. св-ва, как и электр. характеристики, в значительной степени определяются чистотой, а также видом предшествующей мех. обработки.
Предел прочности на растяжение отожженного 25—27 кгс/мм2 при относительном удлинении 20—25%; НВ = 100.
Химические свойства
Наиболее важное их отличие от титана состоит в том, что низкие степени окисления встречаются крайне редко.
Достоверно известно лишь несколько соединений, где Zr не проявляют высшей степени окисления.
Для таких соединений характерны сильные восстановительные свойства.
В водных растворах солей гидролиз протекает в меньшей степени, чем у солен титана, однако существование свободных ионов Zr⁴⁺ представляется маловероятным.
Координационное число в комплексах этих элементов выше, чем у титана, и равно 7 и даже 8.
Металл особенно в компактном состоянии, при обычных условиях очень стоек по отношению к минералам, кислотам.
Лучший растворитель циркония смесь азотной и фтористоводородной к-т
В металле при норм, условиях всегда содержится некоторое количество растворенных по принципу внедрения атомов кислорода, азота и углерода (растворы внедрения).
При загрязнении кислородом, азотом, углеродом, бромом, водородом и т. д. теряет пластичность и становятся твердым и хрупким.
Цирконий образует сплавы с железом, хромом, марганцем, ванадием, алюминием, медью, углеродом, серой, азотом, фосфором, бором и т. д.
В порошкообразном состоянии он способен поглощать большие количества водорода.
С химической точки зрения металлы подгруппы титана неактивны, устойчивы на воздухе или в воде при нормальных условиях.
При повышенных температурах становятся очень активными по отношению к кислороду, галогенам, сере, азоту, углероду, бору и т. д. Оксиды труднорастворимы.
Элемент не встречается в природе в свободном состоянии и не может быть получен электролизом водных растворов.
Если оксид титана (IV) обладает кислыми свойствами, то оксиды циркония — слабоосновными.
Гидроксид элемента Zr(OH)4 (или в виде гидратированных диоксидов МеO2 · 2Н2O) образуются при обработке растворов соответствующих тетрагалогенидов ZrCl4 щелочами.
Они представляют собой студенистые белые осадки, плохо растворимые в воде; обнаруживают очень слабо выраженные кислые свойства, вследствие чего они почти не реагируют со щелочами.
Основной характер соединении усиливается от циркония к гафнию, у которого появляется, например, способность растворяться в сильных кислотах.
Изотопы
Природный цирконий состоит из изотопов 90Zr (51,5%), 91Zr (11,2%), 92Zr (17,1%), 94Zr (17,4%) и 96Zr (2,8%).
Известны радиоактивные изотопы с массовыми числами 87, 89, 93 и 95 и периодами полураспада соответственно 1,6 ч, 78 ч, 4 х 104 лет и 65 суток.
Получение
Металлический получают гл. обр. магниетермическим способом из тетрахлорида по реакции:
ZrCl4 (пар) + 2Mg (жидк.) → Zr (тв.) + 2MgCl2 (жидк.).
Содержание кислорода, азота и углерода в таком металле в среднем соответственно 0,08; 0,04 и 0,15%.
Для получения высокой чистоты его рафинируют йодидным способом.
При этом происходит реакция:
Zr (тв. неоч.) + 2I2 (200° С) → Zrl4 (пар) (1300° С) → Zr (тв. чист.) + 2I2 (пар).
В ходе реакции йод непрерывно регенерируется и вступает в реакцию с новыми порциями неочищенного Zr при т-ре < 200° С.
Диссоциация йодида Zrl4 протекает при т-ре 1250 — 1350° С на раскаленной металлической нити.
В природе
Содержание циркония в земной коре 1,7·10-2%. Он широко распространен в природе в виде различных минералов.
Из них наиболее важны циркон и бадделеит.
Во всех природных соединениях содержится примесь гафния.
Цирконий широко распространен в земной коре, но концентрированные руды его сравнительно редки.
Разделить цирконий от гафния труднее, чем лантаноиды. Это удается лишь при помощи ионного обмена и экстракции.
Применение
Чаше всего его используют в металлургии и строительстве атомных реакторов: цирконий — материал для конструкции ядерных реакторов.
Высокая коррозионная стойкость циркония позволяет применять его в нейрохирургии.
Из сплавов этого металла делают кровоостанавливающие зажимы, хирургический инструмент и иногда даже нити для наложения швов при операциях мозга.
Здесь он соперничает с металлами V группы— ниобием и танталом.
Zr — один из наиболее перспективных конструкционных материалов для активной зоны реакторов на тепловых нейтронах.
Что обусловлено небольшим сечением захвата тепловых нейтронов, малой плотностью, достаточно высокой т-р он плавления.
Малым значением коэфф. линейного расширения и высокой коррозионной стойкостью во многих агрессивных средах.
Расширяется использование при изготовлении хим. оборудования, в произ-ве специальных сортов стали, а также алюминия сплавов и особенно магния сплавов.
Двуокись находит применение при изготовлении огнеупорных материалов с высокими эксплуатационными характеристиками. См. также Цирконаты, Циркония сплавы.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.