Что такое химия и жизнь
Период интенсивного изучения химического состава организмов и реакций, связанных с обменом веществ, начался сравнительно недавно — около 140 лет назад, но к настоящему времени получено так много опытных данных и сделаны столь значительные теоретические открытия, что мы можем ответить на все эти вопросы. Да, в состав клеток организмов входит некоторый набор соединений, многие из которых выделены в чистом виде и хорошо изучены. Число их хотя и значительно, но вовсе не необозримо велико.
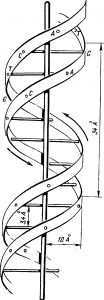
Рис. Химия и жизнь клетка Схема строения молекулы ДНК
Широко известны соединения, относящиеся к классу белков, жиров, полисахаридов, нуклеиновых кислот, витаминов и др. Все они образуются в клетках, но большинство из них уже синтезированы в лабораториях. Неживая природа доставляет организмам воду, кислород, двуокись углерода, соли и т. д.
Строение молекул соединений, играющих важную биохимическую роль, в большинстве случаев удалось раскрыть, использовав современные средства физико-химических исследований. Оказалось, что биологически активные вещества по своей природе близки к соединениям, которые хорошо известны химикам. Так, белки построены из остатков аминокислот, нуклеиновые кислоты из углеводов, остатков фосфорной кислоты и некоторых пиримидинов и пуринов и т. д.
В этом смысле нельзя утверждать, что в области биохимии мы встречаемся с какими-то неслыханно сложными и совершенно необычными молекулами. И химические связи в этих молекулах хотя и отличаются некоторыми характерными чертами, но в общем такие же, что и у известных органических молекул, а характерные черты (например, сопряжение электронных систем) можно обнаружить и у веществ, не имеющих прямого отношения к жизни, например в углеводородах.
Что касается реакций, то здесь надо сказать, что клетка действительно способна поразить воображение химика, изучающего различные превращения исходных веществ в нужные ему продукты. Такие поиски входят в программу работы химика и технолога, когда они хотят наладить новое химическое производство; приходится исследовать множество реакций и отбрасывать все те, которые, несмотря на тщательный подбор условий и катализаторов, все же идут слишком медленно и практически себя не оправдывают. Клетки располагают столь совершенными катализаторами, что их деятельность может служить образцом для любого химического завода. Каталитические механизмы клетки справляются с труднейшими химическими задачами, например осуществляют фиксацию атмосферного азота при невысоких температурах.
Биохимические машины заслуживают самого внимательного изучения и моделирования. Но и химики не беспомощны в обращении с катализаторами. Существует большое число катализаторов, которые по типу действия сходны с природными. Важно подчеркнуть, что химия и жизнь это основные химические законы биохимических процессов — это те же законы, которым следуют и реакции, протекающие просто в пробирке. Как бы ни были сложны молекулы ферментов, общие законы катализа, построенные на фундаменте химической кинетики и термодинамики, обязательны и для них.
Биохимические процессы
Трудности, с которыми сталкивается ученый, размышляющий о возникновении жизни, обусловлены тем, что известные законы физики и химии не дают возможности предвидеть, в какой именно обстановке обязательно возникнет жизнь.
Каждый отдельно взятый биохимический процесс, каждое отдельно изучаемое вещество не является чем-то необычным, но то, что представляет собой совокупность процессов, только одними химическими законами не исчерпаешь. Убедительным аргументом в пользу утверждения, что жизнь представляет собой специфическую и не сводимую к простейшим форму движения материи, может служить принцип единства биохимического плана строения организмов. Мы недаром все время говорили об организмах и клетках вообще, не указывая название живого существа, взятого в качестве примера. Как это ни странно, но состав всех важнейших соединений и даже типы характерных реакций и строение молекул ферментов одинаковы или сходны не только у животных, но и у растений и даже бактерий.
Я помню удивление, которое я испытал впервые, заглянув в книгу, называющуюся «Биохимия растений». Мне хотелось ознакомиться с биохимией животных, но под рукой не оказалось нужного учебника, и я без особого интереса перелистал неподходящую книгу. В ней оказались точно такие же формулы и точно такие же схемы реакций, какие я ожидал увидеть в «Биохимии животных». Клетки разнообразных организмов словно построены из одних и тех же химических узлов. Природа комбинирует одни и те же катализаторы, одни и те же активные молекулы, приспособления для синтеза белков для энергетического сопряжения реакций и другие детали «биохимических машин», так что получаются клетки бактерий, растений или высших животных. Правда, у высших организмов имеются клетки, специализирующиеся на выполнении определенной функции,— клетки печени, клетки мозга и т. д. Существуют и видовые отличия в белках клеток, но основные химические механизмы, поддерживающие жизнь клетки, в основном одинаковы у всех организмов. Миллионы лет работают эти химические машины, и с необыкновенным упорством воспроизводятся они в организмах бесчисленных поколений, сменяющих друг друга на поверхности Земли и водах океанов. В Индийском океане рыбаки выловили рыбу, совсем не похожую на рыб известных видов. Специалисты палеозоологи, изучившие доставленный им экземпляр, были потрясены. Таинственная рыба оказалась целакантусом. Предполагалось, что эти рыбы вымерли 70 миллионов лет назад; доказательство того, что они не полностью исчезли и продолжают жить и размножаться в глубинах океана, произвело настоящую сенсацию в ученом мире.
К настоящему времени поймано и исследовано уже довольно много экземпляров древней рыбы. С точки зрения биохимии эта находка имела особое значение. Исследование организма рыбы древнего вида позволяет выяснить, насколько изменился химический состав за миллионы лет биологической эволюции. Сравнение данных анализа гемоглобина крови целакантуса и современных рыб показало, что между их гемоглобинами нет существенной разницы. Это означает, что химическая эволюция, т. е. перестройка отдельных узлов биохимических механизмов, если и идет, то крайне медленно; словно природа нашла удачный набор исходных веществ и принялась строить из него всевозможные формы живых существ.
Целакантус — это рыба, находящаяся на сравнительно ранней стадии развития — ее сердце и гипофиз организованы примитивно; биологическая перестройка совершалась «на фоне»
неизменной химической организации. Химик, изучавший только состав отдельных молекул, конечно, не мог бы предвидеть всего этого.
Набор веществ
Единство биохимического плана строения клеток и организмов указывает на какие-то особенности определенного круга соединений, послуживших материалом для формирования биохимических машин. Почему, действительно, из огромного множества неизвестных соединений углерода (их насчитывается несколько миллионов) выбраны только некоторые, а другие, очень похожие на них, оказались неподходящими. Так, в организмах встречаются α-аминокислоты, β-формы их крайне редки; только левовращающие оптические изомеры подходят для клетки, правовращающие она отвергает. Какие особенности этого набора веществ сделали его незаменимым так, что даже сотни миллионов лет развития жизни не внесли существенных корректив в химию организмов? Означает ли это, что жизнь вообще возможна только при таком уникальном наборе соединений, а все другие варианты надо оставить заботам авторов фантастических романов?
Чтобы найти разъяснение, мы вынуждены обратиться к свойствам веществ жизни и проследить, что же происходит с ними в клетках, т. е. заняться самой настоящей химией жизни.
Но, признав тем самым существование этой отрасли науки, мы еще не узнали всех ее необыкновенных законов. Нам известно только, что законы обычной химии здесь не отменяются, их, однако, можно дополнить.
Динамические структуры
Результаты наблюдений и опытов, проведенных на основе современных методов, приводят к бесспорному выводу: все вещества жизни, все соединения и даже сложные надмолекулярные структуры клетки непрерывно разрушаются и создаются вновь. Клетка и организм в целом представляют собой динамическую структуру, — эта форма существования материи поддерживается сложнейшим комплексом непрерывно текущих реакций, непрерывным движением.
Непосредственное изучение скоростей обмена стало возможном после развития изотопных методов исследования.
Если вводить, в пищу животного небольшие количества радиоактивного («меченого») фосфора (обычно пользуются фосфатами, содержащими радиоактивный изотоп фосфора) и измерить спустя короткое время радиоактивность отдельных органов, то можно убедиться, как быстро атомы введенного «меченого» фосфора заменили собой атомы фосфора, находившиеся в тканях в виде разнообразных соединений (АТФ, активные группы ферментов и т. п.).
Обмениваются отдельные атомы, целые группы атомов; распадаются и тут же заново создаются сложнейшие, поистине ажурные структуры клеток. Так, например, каждую секунду кроветворные органы человека производят 80 000 000 эритроцитов. В состоянии равновесия такое же количество эритроцитов и разрушается. Этот колоссальный темп динамических процессов кажется еще более удивительным, если вспомнить, что эритроцит— сложная частица, имеющая набор ферментов и тонкую внутреннюю структуру.
Если сравнить картины неживой природы с тем, что раскрывается перед глазами исследователя, изучающего клетку и ее химические механизмы, то прежде всего бросается в глаза необыкновенно высокая организация форм жизни. Часовщик, собирающий сложный механизм из крошечных деталей и орудующий тончайшими инструментами, выполняет работу, которая покажется нам очень примитивной и грубой, по сравнению с тем, какими удивительными пинцетами природа отбирает нужные молекулы и отдельные части молекул и как прихотливо и безошибочно помещает она каждый фрагмент на свое место.
Что бы вы сказали о машине, которая бродит по свету, сама разыскивает различные материалы и непрерывно заменяет свои изношенные части новыми, новые детали она тут же и изготовляет из этих материалов. Машина производит себе подобные машины, так что она практически бессмертна. Мало этого — машины понимают друг друга, они связаны с окружающим миром.
Это, конечно, не машина, это живой организм, и сравнение с машиной здесь приведено лишь для того, чтобы подчеркнуть высокую степень организации живых существ. Но ведь организация клеток и их совокупностей достигается согласованной работой химических процессов и, следовательно, относится к химии жизни.
Все это совсем не похоже на законы элементарной химии и кинетики. Мы вступили в область качественно новых явлений, которые тем не менее неразрывно связаны с химическими процессами. Вот так постепенно понятие «химия жизни» наполняется содержанием и вызывает желание получить больше детальных сведений о его химической стороне.
Элементарный состав организмов
Сведения о том, какие именно элементы и в каких количествах входят в состав клеток и организмов, представляют лишь относительную ценность. Для понимания смысла биохимических явлений, разумеется, надо знать, в виде каких соединений входит в клетки тот или иной элемент и каковы функции молекул соединения — выполняют ли они роль катализаторов, служат ли целям регулирования их активности, принимают ли участие в синтезе белков и т. д. К большому сожалению сведения о природе связи многих элементов, действующих в растительных и животных организмах, далеко не полны, и лишь о некоторых мы можем уверенно сказать, что знаем их главные функции.
Чаще всего приходится ограничиваться описанием характера изменений, возникающих при недостатке или избытке данного элемента в пище, и указанием на его предполагаемую роль. Химической основой жизни, по-видимому, надо считать соединения всего 16 элементов, постоянно встречающихся на всех уровнях биологической организации. Эти элементы незаменимы, и молекулы их соединений образуют все наиболее ответственные части клетки: оболочку, ядро, плазму, эндотелиальную сеть, рибосомы, где синтезируется белок, и т. д. Кроме этих 16 элементов, в организмах находят очень большое число соединений, содержащих ионы различных металлов той или иной степени окисления. Одни из них могут быть заменены, другие попадают в организм вместе с пищей и специальных функций не несут, а о роли третьих мы еще ничего не знаем. Количество неметаллических элементов в клетках невелико, так как неметаллов меньше, чем металлов.
В число 16 элементов жизни входят: углерод, водород, кислород, сера, фосфор, азот, железо, медь, натрий, калий, кальций, магний, кобальт, хлор, иод, марганец. Вероятно, надо добавить еще цинк.
Атомы углерода образуют основной «каркас» почти всех молекул и прежде всего белковых частиц, участвующих в процессах жизнедеятельности, поэтому углерод, вероятно, следует считать важнейшим «элементом жизни».
До сих пор не обнаружено каких-либо организмов, существование которых не было бы связано с наличием в них белковых соединений. Но белки содержат, кроме атомов углерода, еще водород, кислород, азот и серу; этим и определяется значение названных элементов в химии жизни. Белковая среда внутри клетки есть арена сложнейших процессов, в результате которых пищевые вещества превращаются в «сырье» для производства новых белковых молекул, создаются высокоспециализированные катализаторы, возникают системы химического регулирования, обеспечивающие их согласованную деятельность и т. д. Практически все биологические катализаторы (ферменты) являются теми или иными белками.
Азот, фосфор, углерод, кислород и водород входят также в состав нуклеиновых кислот, с помощью которых осуществляется передача наследственных признаков и воспроизводство клеток и организмов. Те же пять элементов находятся в молекулах соединений, которые выполняют функцию аккумуляторов и дают возможность природе синтезировать вещества, богатые энергией. Жироподобные липиды содержат цепочки атомов углерода, атомы кислорода, фосфора, водорода и иногда азота; из белков и липидов строятся мембраны — тонкие оболочки, окружающие плазму клетки и образующие все ее внутренние структуры. Мембраны — основной строительный материал клетки — выполняют разнообразные химические и физические функции; даже передача нервного возбуждения неразрывно связана процессами в мембранах.
Во многих белках имеется сера. Связи между ее атомами поддерживают общую форму белковой молекулы. Очень важна так же роль этого элемента в процессах переноса водорода.
Атомы водорода отнюдь не пассивные составные части белков, липидов, нуклеиновых кислот, ферментов и т. п. Многие из них способны перемещаться от одной молекулы к другой в виде иона Н+ и иона Н— (гидридный ион). Атом водорода может отдать свой электрон в цепь т. н. переносчиков (например, белковых соединений железа — цитохромов); проходя по этой цепи, электрон теряет энергию и способствует образованию богатых энергией соединений (аденозинтрифосфорной кислоты «АТФ»), а ион водорода при этом поступает в окружающую среду. Такой способ использования энергии пищевых веществ распространен в природе, поэтому отщепление от их молекул водорода и создание потока электронов, несущего энергию, представляет собой важнейший механизм жизнедеятельности, в значительной мере и определяющий биологическую ценность водорода.
На заключительном этапе окисления пищевых веществ (в клетках, живущих в кислородной атмосфере) электроны попадают к атомам кислорода и превращают их в отрицательно заряженные ионы; эти ионы с ионами водорода образуют воду (или пероксид водорода). Для появления ионов кислорода необходимы специфические условия и действия ферментов, так как молекулы кислорода сами по себе малоактивны.
Из группы галогенов важную роль играют хлор, ионы которого активизируют некоторые биологические катализаторы, и йод, входящий в состав гормона щитовидной железы. Этот гормон регулирует общий темп окислительных процессов в организме.
Функции брома изучены недостаточно. Фтор входит в состав арочных соединений, образующих костную ткань и эмаль зубов.
И избыток и недостаток этого элемента в организме сказывается прежде всего на состоянии зубной эмали.
Остальные из названных выше элементов — металлы. Каковы же их функции? Какая роль, например, магния, для чего нужны организму калий и натрий, каковы функции ионов кобальта, сделавшие его необходимым для нормальной работы организма? Не всегда удается дать исчерпывающие ответы на подобные вопросы. В дальнейшем мы изложим те сведения о роли ионов металлов в ферментных системах, которые могут считаться надежно установленными. Природа экономно использует металлы — их содержание в организмах невелико, и ион каждого вида выполняет важные функции. Чаще всего они связаны с усилением действия биологических катализаторов или образованием специфических активных групп катализаторов — металлсодержащих ферментов.
Иногда один металл можно заменить другим; так, фермент, распространенный в растительном мире, тирозиназа активизируется ионами железа, марганца и кобальта; еще более разнообразны активаторы фермента карбоксилазы: железо, марганец, кадмий, барий, медь, никель, свинец, цинк. Металлы, содержащиеся в организмах, находятся там в виде комплексных ионов, которые образуются в результате присоединения к иону металла различных органических молекул. Причины, по которым действие металлов связано с комплексообразованием, заключаются в том, что соединение иона с органическими молекулами или другими ионами в комплексе сопровождается глубоким изменением свойств иона, и прежде всего его каталитической активности.
Способность катализировать разнообразные процессы в биологических системах часто резко увеличивается при комплексо-образовании. Так, при взаимодействии иона железа с органическим амином — пирролом, приводит в определенных условиях к образованию соединения, относящегося к классу железопорфиринов. Это соединение обладает способностью разлагать (каталитически) пероксид водорода и ускорять реакции окисления в гораздо большей степени, чем просто раствор солей железа. Особенно важно то, что комплексообразование может привести к появлению у иона качественно новых функций. Так, ионы цинка практически не катализируют разложение пероксида водорода и гидрокарбонатов, а комплексные соединения цинка ускоряют эти процессы; каталитическое разложение гидрокарбонатов, содержащихся в крови, комплексным соединением цинка (и составе фермента карбонангидразы) обусловливает освобождение крови от углекислоты и обеспечиваем нормальный
Каталитические реакции, происходящие в клетках, чаще всего сводятся к переносу различных частиц и целых групп aтомов. В процессах перестройки молекул биологические катализаторы— ферменты переносят электроны, ионы водорода, группы ОН, СН3 и т.д.
Для осуществления переносов необходима, во-первых, определенная геометрическая ориентация реагирующих молекул, а во вторых, определенный уровень их активности.
Повышение активности может быть достигнуто разными способами, но соединение с ионом металла в комплекс представляет собой один из важнейших путей активации.
В комплексах частицы, присоединяющиеся к иону металла (лиганды), испытывают поляризацию и в свою очередь влияют на состояние электронов металла. В комплексе ион-лиганды электроны распределены по энергетическим уровням иначе, чем в ионе и лиганде, взятом в отдельности. Жесткое пространственное размещение лигандов вокруг центрального иона в сравнительно небольшом пространстве сближает лиганды и открывает возможность для протекания таких реакций, которые с трудом могли бы происходить в среде, содержащей хаотически распределенные частицы.
Реакции в комплексах выражаются во взаимодействии ион-лиганд, лиганд-лиганд или ион-лиганд с посторонней частицей. Реакция между ионом и присоединившимся к нему лигандом может приводить к окислительно-восстановительному процессу. Например, при взаимодействии ионы иода, присоединившись к иону меди (II), отдают ему электроны и понижают степень окисления меди до (I). Взаимодействие лигандов наблюдается, например, при комплексообразовании ионов меди с водой и сложными эфирами; в комплексе поляризующее действие иона меди на молекулы воды и эфира облегчает реакцию между ними (гидролиз изопропилфторфосфата).
Особенно большое значение имеют реакции, в которых ионы металлов связаны с лигандами, не изменяющимися в результате реакции, но повышающими химическую активность иона. Так, комплексы иона кобальта с аминокислотой — гистидином способны переносить кислород так же, как это происходит у комплексных соединений железа (гемоглобин). Порфириновые комплексы железа и меди играют важнейшую роль в качестве активных групп биологических катализаторов, а сходный по структуре порфириновый комплекс магния участвует в процессе фотосинтеза. Комплексное соединение кобальта, содержащее порфирин, представляет собой витамин В12, необходимо для синтеза гемоглобина.
Даже в тех случаях, когда ионы металлов не образуют таких высокоактивных и прочных комплексов, они способны ускорять очень сложные превращения; каталитическое действие иона железа может быть, например, обусловлено присоединением к нему группы ОН, изменением формы молекулы, расположенной около иона, и поворотом иона с группой ОН. В итоге ион железа как бы «пересаживает» группу ОН с одного места молекулы на другое.
Ионы металлов регулируют и явления, происходящие в нервных клетках. Передача нервного возбуждения — процесс, в котором определяющую роль играет проникновение ионов натрия и калия сквозь оболочку (мембрану) нерва.
Ритм работы органов в организме в целом связан с концентрацией ионов металлов, особенно ионов калия, натрия, кальция и магния. Эти ионы действуют на различные ферментные системы и, варьируя отношения их концентраций, можно изменять ритм сердечной деятельности, скорость выведения воды почками, уровень свертываемости крови, темп роста костной системы и т. д.
Все эти разнообразные функции ионов металлов и обусловливают те феноменологические эффекты, которые привлекли внимание химиков, врачей, ботаников и агрономов, изучавших развитие и состояние животных и растений в условиях, когда содержание того или иного элемента в пище и окружающей среде существенно отклонялось от нормы.
Необходимо подчеркнуть, что выяснение роли ионов металлов и некоторых неметаллов (хлор, иод) в работе каталитических и регулирующих систем клетки и организма еще не дает возможности полностью предвидеть характер тех внешних и внутренних изменений, которые вызываются недостатком или избытком ионов. Дело в том, что организм представляет собой сбалансированную систему, существование которой поддерживается множеством одновременно протекающих реакций и нарушение работы одного «звена» системы отзывается не только на состоянии этого звена, но и других, отдаленных от него. Поэтому очень трудно предвидеть все симптомы расстройства функций организма, вызванного нарушениями ионного баланса; систематизация и накопление и чисто фактического материала в этой области имеет и поныне большое значение.
По мере расширения круга наших знаний о химическом составе почв, вод и организмов начали вырисовываться контуры новой отрасли естествознания — биогеохимии, объединившей геологические, биохимические проблемы.
Основателем биогеохимии по справедливости считается академик В. И. Вернадский.
Одной из центральных проблем этой науки является, по мысли В. И. Вернадского, выяснение связи между химическим составом организмов и земной коры. Биохимические процессы рассматриваются В. И. Вернадским и созданной им школой советских биогеохимиков не обособленно, а в тесной связи с химией земной коры.
Статья на тему Химия и жизнь

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.