Ион водорода образуется в результате потери электрона. Протон, положительно заряженный ион водорода, способен легко соединяться с другими частицами, поэтому он наблюдается в изолированном состоянии лишь в газообразной форме или в пространстве, почти свободном от частиц.
Однако из-за своей экстремально высокой плотности заряда, примерно в 2 × 1010 раз большей, чем плотность заряда натрия, обычный ион водорода не способен существовать свободно в растворе, так как быстро гидратируется, то есть привлекается и связывается с другими частицами.
В зависимости от заряда, ионы водорода делятся на два различных класса: положительно заряженные и отрицательно заряженные ионы.
Что такое ион водорода
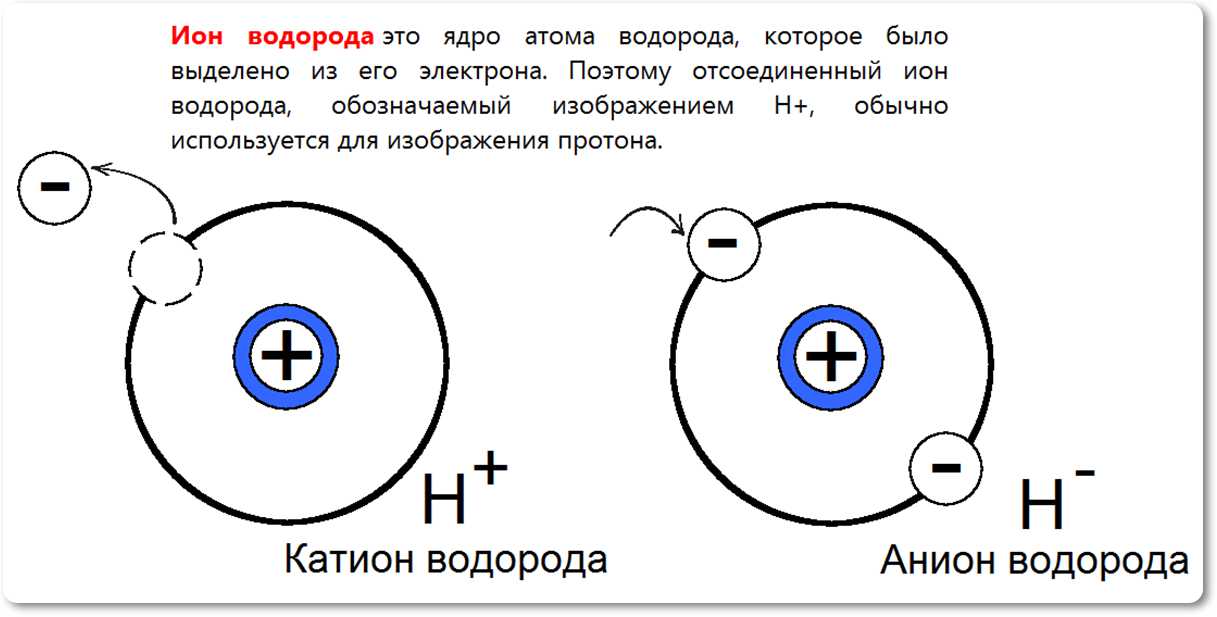
Ион водорода это ядро атома водорода, которое было выделено из его электрона. Протон — это молекула с единицей положительной электрической энергии, которая образует ядро водорода.
Поэтому отсоединенный ион водорода, обозначаемый изображением H+, обычно используется для изображения протона.
Таким образом, приведенное выше определение помогает получить формулу иона H+ и иона водорода.
Когда существует изолированный атом водорода, он отображается как ион H+.
Он может функционировать только в помещениях, практически не содержащих частиц, также известных как места с высоким вакуумом или в газообразном состоянии.
Это происходит потому, что простое ядро может легко соединяться с другими данными частицами или элементами, такими как электроны, атомы и молекулы.
Водный раствор: Формула иона водорода
Формула H+H2O представляет ион гидрония или оксония. Он также записывается как H3O+. В водном растворе количество иона водорода определяет активность вещества.
Это означает, что если концентрация ионов водорода высока, то раствор будет более кислым, а рН — более низким.
Заряд на водороде
Атом водорода имеет один электрон и заряженное ядро + 1. Что, в свою очередь, дает единственный положительно заряженный ион, который может существовать, содержащий заряд + 1. Обычно он известен как + 1.
Интересный факт: подкисление океана является прямым результатом повышения концентрации ионов водорода и насыщения карбонатом, вызванного значительным поглощением СО2 мировым океаном.
Антропогенные выбросы в результате сжигания ископаемого топлива, производства цемента и улучшения землепользования увеличили поглощение океанами углекислого газа из атмосферы на 30% со времен промышленной революции.
Как найти концентрацию ионов водорода зная ph
Концентрация иона водорода позволяет нам определить концентрацию кислотности или щелочную структуру иона.
Наиболее распространенным и приемлемым примером может быть вода (H2O). Большинство молекул воды имеют стабильную и известную форму.
Его более глубокие соединения распадаются на ионы водорода и гидроксид-ионы, то есть H+ и OH—.
Фактически, рН воды определяется балансом водорода и гидроксид-ионов.
Раствор является кислым, когда количество ионов водорода превышает количество гидроксид-ионов. Если ситуация обратная, раствор является щелочным.
Для любого раствора наблюдается следующая зависимость между плотностями ионов водорода (H+) и гидроксид-ионов (OH—), если температура не меняется: [H+][OH—] = Kw =10-14 (фиксированная) при 25 ºC.
В чистой воде или нейтральном растворе:
[H+]=[OH—] ,
[H+]=[OH—]=√(кВт)=√10-14=10-7
Если известно значение либо [H+], либо [OH—], то может быть определено значение другого параметра.
Таким образом, рН определяется концентрацией ионов водорода:
pH = -log10[Н+]
Использование иона водорода
1. В процессе фотосинтеза ионы водорода приводят в действие АТФ-синтазу. Поскольку ионы водорода проходят через мембрану, высокая концентрация возникает в тилакоидной мембране, а низкая — в цитоплазме.
2. Осмос, с другой стороны, заставляет H+ выходить из мембраны через АТФ-синтазу. Протоны будут вращать АТФ-синтазу, которая будет производить АТФ, используя свою кинетическую энергию для выхода.
Это также происходит при клеточном дыхании, хотя концентрированная мембрана является внутренней мембраной митохондрий, а не плазматической мембраной.
3. Кислотная или основная сущность соединения часто определяется концентрацией ионов водорода, которая рассчитывается как рН. Анионы H+ и гидроксида образуются при разрушении молекул воды, известном как самоионизация воды.
Разница между химией H и H+
Ион H+ — Когда электрон удаляется из атома водорода, остается только протон. Он разлагается на положительно заряженный ион водорода H+.
2. H С другой стороны, атом водорода редко остается сам по себе, потому что его неспаренный электрон все еще ищет другой электрон.
H+ Это тот вид водорода, который используется для выработки фермента АТФ, который управляет нашими митохондриями и клетками.
3. H Более распространен водород в его молекулярной форме.
H+ Шкала pH основана на содержании иона водорода H+.
Интересный факт: угольная кислота (H2CO3), слабая дипротонная кислота, образуется при взаимодействии растворенного атмосферного диоксида углерода (CO2(aq)) с молекулами воды в поверхностных водах.
Каждая молекула дипротовой кислоты содержит два ионизируемых атома водорода.
В водном растворе при частичной диссоциации угольной кислоты образуются протон водорода (H+) и бикарбонат-ион (HCO3—), который затем диссоциирует на другой протон водорода и карбонат-ион (CO32-).
Растворение и диссоциация этих неорганических форм углерода приводят к увеличению концентрации ионов водорода и, как следствие, к снижению рН поверхности океана в атмосфере.
Быстрые ответы?
Водородные ионы, представляют собой положительно заряженные атомы водорода.
Ион водорода. H+. Брутто-формула: H.
Водородоподобный атом или ион представляет собой любое атомное ядро, которое имеет один электрон и, следовательно, является изоэлектронным атому водорода.