Периодическая система элементов
Li Be В С N О F Ne Na Mg Al Si Р S ClAr
При таком расположении в вертикальные столбики попадают элементы, сходные по своим свойствам и обладающие одинаковой валентностью, например литий и натрий, бериллий и магний и т. д.
Разделив все элементы на периоды и располагая один период под другим так, чтобы сходные по свойствам и типу образуемых соединений элементы приходились друг под другом, Менделеев составил таблицу, названную им периодической системой элементов по группам и рядам. Эта таблица в современном ее виде, дополненная открытыми уже после Менделеева элементами. Она состоит из десяти горизонтальных рядов и девяти вертикальных столбцов или групп, в которых один под другим размещены сходные между собой элементы.
Обратим вначале внимание на расположение элементов в горизонтальных рядах. В первом ряду стоят только два элемента — водород в начале ряда и гелий в конце его. Эти два крайних элемента и составляют первый период, в котором как бы отсутствуют все промежуточные члены.
Второй и третий ряд
Второй и третий ряды состоят из рассмотренных уже нами элементов и образуют два периода по восьми элементов в каждом. Оба периода начинаются со щелочного металла и заканчиваются инертным газом. Все три периода называются малыми периодами.Четвертый ряд также начинается со щелочного металла калия.
Судя по тому, как изменялись свойства в двух предыдущих рядах, можно было бы ожидать, что и здесь они будут изменяться в той же последовательности и седьмым элементом в ряду будет опять галоген, а восьмым — инертный газ. Однако этого не наблюдается. Вместо галогена на седьмом месте находится марганец, имеющий очень мало общего с галогенами.
Это — металл, правда, переходного характера, образующий как основные, так и кислотные окислы, из которых высший Mn2O7 аналогичен окислу хлора Cl2O7. После марганца в том же ряду стоят еще три элемента — железо, кобальт и никель, очень сходные друг с другом, но не имеющие ничего общего с инертными газами. И только следующий, пятый ряд, начинающийся с меди, заканчивается, наконец, инертным газом криптоном. Шестой ряд снова начинается со щелочного металла рубидия и т. д.
Таким образом, у элементов, следующих за аргоном, более или менее полное повторение свойств наблюдается только через 18 элементов, а не через восемь, как было во втором и третьем рядах. Эти 18 элементов образуют так называемый большой период, состоящий из двух рядов.
Один большой период составляют и следующие два ряда, шестой и седьмой. Этот период начинается щелочным металлом рубидием и заканчивается инертным газом ксеноном.
В восьмом ряду появляется новое осложнение. Здесь после лантана идут 14 элементов, называемых металлами редких земель или лантанидами , которые встречаются в очень небольших количествах и чрезвычайно сходны с лантаном и между собой. Ввиду этого сходства, обусловленного особенностью строения их атомов , лантаниды помещают теперь вне общей таблицы, отмечая лишь в клетке для лантана их положение в системе.
Так как следующий за ксеноном инертный газ радон находится только в конце девятого ряда, то восьмой и девятый ряды тоже образуют один большой период, охватывающий 32 элемента.
В больших периодах не все свойства элементов изменяются так последовательно, как во втором и третьем периодах. Здесь-наблюдается еще некоторая периодичность в изменении свойств внутри самих периодов.
Так, например, валентность вначале равномерно растет при переходе от одного элемента к другому, но затем, достигнув максимума в середине периода, сразу падает до единицы, после чего опять возрастает до семи к концу периода. В связи с этим большие периоды разделены каждый на две части (два ряда), образующие как бы самостоятельные периоды.
Десятый ряд содержит 15 элементов, из которых первый и последние девять получены лишь сравнительно недавно искусственным путем. Последние девять элементов, а также предшествующие им уран, протактиний и торий, очень сходны по строению их атомов с актинием, поэтому их под названием актиниды помещают вне общей таблицы, подобно лантанидам.
Итак, десять горизонтальных рядов таблицы образуют три малых, три больших и один незаконченный период. Первый период начинается с водорода, остальные с одного из, щелочных металлов. Каждый период заканчивается инертным газом.
В вертикальных столбцах таблицы, или в группах, располагаются элементы, обладающие сходными свойствами. Поэтому каждая вертикальная группа представляет собой как бы естественное семейство элементов. Всего в таблице таких групп девять. Номера групп отмечены вверху римской цифрой. Внизу таблицы помещены типы высших солеобразующих окислов, характерных для каждой группы.
Валентность элементов
В первой группе находятся элементы, образующие окислы типа R2O,во второй — типа RO, в третьей — типа R2O3 и т. д. Таким образом, наибольшая валентность элементов каждой группы в их кислородных соединениях, за немногими исключениями, соответствует номеру группы.
Валентность по водороду также может характеризовать группу. Элементы первой, второй и третьей групп почти исключительно металлы, которые или не образуют соединений с водородом, или образуют соединения, представляющие собой твердые вещества, разлагаемые водой. Металлоиды же, находящиеся в четвертой, пятой, шестой и седьмой группах, дают характерные газообразные водородные соединения, типы которых приведены внизу таблицы.
Мы видим, что в то время как валентность металлоидов по кислороду непрерывно возрастает, валентность по водороду, равная в четвертой группе четырем, наоборот, убывает, причем сумма обеих валентностей (по кислороду и водороду) остается равной восьми. Последнее обстоятельство дает возможность определить одну валентность по другой. Так, например, помня, что азот трехвалентен по водороду (NH3), мы находим, что наибольшая его валентность по кислороду равна пяти (8 — 3 = 5).
Сравнивая элементы, принадлежащие к одной и той же группе, нетрудно заметить, что, начиная с четвертого горизонтального ряда, каждый элемент обнаруживает наибольшее сходство не с элементом, расположенным непосредственно под или над ним, а с элементами, отделенными от него одной клеткой.
Например, в седьмой группе бром не примыкает непосредственно к хлору и иоду, а отделен от каждого из них одним элементом; находящиеся в шестой группе сходные элементы — селен и теллур разделены молибденом, имеющим с ними мало общего; находящийся в первой группе калий обнаруживает большое сходство с рубидием, стоящим в шестом ряду, но мало похож на расположенную непосредственно под ним медь, и т. д.
Это обстоятельство связано с тем, что с четвертого ряда начинаются большие периоды, состоящие каждый из двух рядов — четного и нечетного, расположенных один над другим. Поэтому в каждую группу попадает один элемент из первой половины периода (четный ряд) и один из второй (нечетный ряд).
Так как в пределах периода металлические свойства ослабевают в направлении слева направо, то понятно, что у элементов четных рядов они выражены, в общем, сильнее, чем у элементов нечетных рядов. Чтобы отметить такое различие между рядами, элементы четных рядов больших периодов сдвинуты в таблице несколько влево, а элементы нечетных рядов — вправо.
Таким образом, начиная с четвертого ряда каждую группу периодической системы, кроме восьмой и нулевой, можно разбить на две подгруппы: «четную», состоящую из элементов четных рядов больших периодов, и «нечетную», образованную элементами нечетных рядов. Что же касается элементов второго и третьего периодов, которые Менделеев назвал типическими, то в одних грушах они ближе примыкают по своим свойствам к элементам четных рядов, в других — к элементам нечетных рядов.
Поэтому типические элементы обычно объединяют со сходными с ними элементами четных или нечетных рядов в одну главнуюподгруппу, являющуюся более характерной для данной группы; в таком случае другая подгруппа называется побочной. В связи с этим типические элементы первой и второй групп сдвинуты в таблице влево, а остальных групп — вправо.
Различие между главной и побочной подгруппами
Различие между главной и побочной подгруппами наиболее ярко проявляется в крайних группах таблицы (не считая восьмой и нулевой). Так, в первой группе главную подгруппу образуют элементы четных рядов больших периодов — калий, рубидий, цезий и франций, к которым примыкают и элементы второго и третьего рядов—литий и натрий.
Все они обладают резко выраженными металлическими свойствами, энергично разлагают воду,, образуя сильные щелочи. Побочную подгруппу составляют медь, серебро и золото, обнаруживающие мало сходства с элементами главной подгруппы. Наоборот, в седьмой группе главную подгруппу составляют металлоиды — фтор, хлор, бром и иод, в побочной же находятся элементы четных рядов — марганец, технеций и рений, у которых преобладают металлические свойства.
В главных подгруппах можно хорошо проследить, как с увеличением атомного веса усиливаются металлические свойства элементов.
Восьмая группа элементов занимает особое положение в периодической системе. Она содержит всего девять элементов, причем в одном горизонтальном ряду помещаются сразу три довольно сходных между собой элемента. Эти «триады» составляют переходы от конца одного горизонтального ряда к началу другого в каждом большом периоде. Элементы восьмой группы должны были бы иметь наибольшую валентность по кислороду, равную восьми. Однако до сих пор лишь для немногих из них получены высшие окислы типа RO4.
История создания таблицы Менделеевым
Первоначально таблица Менделеева содержала всего восемь групп, так как инертные газы аргон, гелий и др. в то время были еще неизвестны. Впоследствии, когда были открыты инертные газы, пришлось отвести для них новую группу.
Менделеев поместил их впереди первой группы и дал новой группе название нулевой,которое, кроме порядкового значения, указывает еще на особый химический характер группы: члены ее не вступают в соединения с другими элементами, т. е. обладают как бы нулевой валентностью. Однако в настоящее время по причине, о которой мы скажем позже, нулевую группу обычно помещают в таблице в последней графе справа.
Следует отметить, что еще в 1883 г. за 11 лет до открытия первого из инертных газов — аргона — русский революционер-ученый Н. А. Морозов, заключенный царским правительством за участие в революционном движении в Шлиссельбургскую крепость, предсказал существование инертных газов, вычислил теоретически их атомные веса и точно определил место инертных газов в периодической системе. Но об этом замечательном предвидении Морозова стало известно только после его освобождения из крепости в 1905 г. и появления в печати его трудов, написанных в одиночном заключении.
При построении периодической системы Менделеев руководствовался принципом расположения элементов по возрастающим атомным весам. Однако, как видно из таблицы, в трех случаях этот принцип оказался нарушенным.
Так, аргон (ат. вес 39,944) стоит впереди калия (ат. вес. 39,100), хотя его атомный вес больше, чем калия, кобальт (ат. вес 58,94) находится впереди никеля (ат. вес 58,71) и теллур (ат. вес 127,61) —впереди иода (ат. вес 126,91). Здесь Менделеев отступил от принятого им порядка, исходя из свойств этих элементов, требовавших именно такой последовательности их расположения. Таким образом, он не придавал решающего значения атомному весу и при установлении места элемента в таблице руководствовался всей совокупностью его индивидуальных свойств.
Позднейшие исследования показали, что произведенное Менделеевым размещение элементов в периодической системе является совершенно правильным и соответствует строению атомов.
Итак, в периодической системе свойства элементов, их атомные веса, валентность, химический характер и т. д. изменяются в известной последовательности как в горизонтальном, так и в вертикальном направлении. Место элемента в таблице определяется, следовательно, его свойствами, и, наоборот, каждое место занимает элемент, обладающий совершенно определенной совокупностью свойств. Поэтому, зная положение элемента в таблице, можно довольно точно указать его свойства.
Положим, например, что нам нужно определить свойства элемента, занимающего место в третьем горизонтальном ряду между магнием и кремнием.
Уже из того, что этот элемент находится в третьей группе, следует, что он образует окисел типа R2O3, т. е. что этот элемент трехвалентен. Далее, так как слева от него во второй группе стоит типичный металл магний, а справа в четвертой группе — слабый металлоид кремний, то вероятнее всего описываемый элемент будет тоже металлом, но менее типичным, чем магний.
Это заключение подтверждается еще тем, что одним местом выше в той же группе стоит бор, обладающий очень слабо выраженными металлическими свойствами, а ниже — скандий, имеющий уже вполне ясные металлические свойства. Итак, исследуемый нами элемент — металл.
Следовательно, с водородом он или совсем не соединяется, или образует твердое соединение; окисел его, как окисел элемента, переходного от металла магния к металлоиду кремнию, должен иметь слабо выраженные основные свойства или быть амфотерным, т. е. образующим соли и с кислотами и со щелочами. Таковы действительно свойства элемента алюминия, занимающего выбранное нами место.
Атомный вес алюминия также легко может быть вычислен на основании его положения в таблице как среднее арифметическое из атомных весов его соседей.
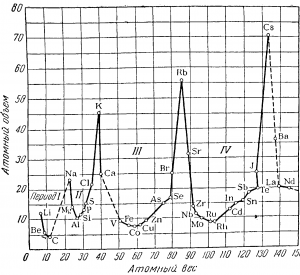
Следует заметить, что не только химические свойства элементов, но и очень многие физические свойства простых веществ-изменяются периодически, если рассматривать их как функции атомного веса. Периодичность в изменении физических свойств-простых веществ особенно ярко выявляется при сопоставлении атомных объемов простых веществ, т. е. объемов, занимаемых грамматомами элементов в твердом или жидком состоянии.
Изображенная на рис. 2 кривая атомных объемов иллюстрирует ход изменения этих величин с возрастанием атомного веса. Высшие точки кривой заняты щелочными металлами, которые обладают наибольшими атомными объемами.
Так же периодически изменяются удельные веса, температуры плавления и кипения и другие физические константы простых веществ.
Статья на тему Периодическая система элементов

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.