Аргон это химический элемент, благородный газ, бесцветный, безвкусный и не имеющий запаха газ.
Благородный газ аргон имеет плотность 1,784 грамма на литр. Когда мы сравниваем плотность аргона с плотностью воздуха, это составляет около 1,29 грамма на литр.
Аргон меняет свое состояние из газообразного в жидкое при температуре -185,86 °C (-302,55 °F). Затем он меняет свое состояние с жидкого на твердое при температуре -189,3 ° C (-308,7 ° F).
Аргон никакого соединения аргона никогда не производилось.

Что такое аргон
(Argon; от греч. — бездеятельный), Аr — химический элемент восемнадцатой группы (18) (устаревшая классификация VIII группы) третьего периода периодической системы элементов.
Атомный номер, 18, атомная масса (молярная масса) аргона 39, 948. Про обычных условиях — инертный газ без цвета, запаха и вкуса.
История
Впервые выделен в 1894 англ. учеными Дне. Редеем и У. Рамзаем из атмосферного азота. Это был первый вид благородных газов, который был выделен.
Рэлей и Рамсей нашли аргон путем фракционной перегонки жидкого воздуха.
Фракционная дистилляция — это метод, при котором жидкий воздух медленно нагревается. Когда воздух нагревается, различные элементы превращаются из жидкости обратно в газ.
Часть воздуха, которая превращается обратно в газ при температуре -185,86 ° C (-302,55 ° F), представляет собой аргон.
Известны стабильные изотопы 36Аr, 38Аr и 40Аr (их содержание в атмосфере соответственно 0, 337; 0, 063 и 99, 600%).
Физические свойства аргона
Основные свойства и термодинамические параметры аргона — критическая точка: т-ра 150, 85 К, давление 48, 30 кгс/см², плотность 0, 536 г/см³, тройная точка: т-ра 83, 81 К, давление 516, 86
Норм, температура кипения 87,293 К, скрытая теплота плавления 280,8 кал/моль, теплота испарения (при норм, т-ре кипения) 1557,5 кал/моль.
Газообразное состояние: плотность (т-ра 0°C давление 760 лж рт. ст.) 0,00178403 г/см³, коэфф. теплопроводности 3,889 • 10-5 кал/см • сен • град теплоемкость (при пост, давлении) 4,98 кал/моль • град, растворимость в воде (см³/л) 52,4 (т-ра 0°С) и 18,1 (т-ра 80° С).
Растворимость понижается при добавлении электролитов. Жидкое состояние: плотность 1,3998 г/см³ (вблизи тройной точки, т-ра 88 К).
Теплопроводность в интервале т-р 86,8—147,0 К уменьшается от 28,9 • 10-5 до 13,0 • 10-5 кал/ем • сек • град, теплоемкость (при пост, давлении) в интервале т-р 85—140 К изменяется от 0,2083 до 0,383 кал/г • град.
Вязкость в интервале т-р 84—150 К изменяется от 2,83 • 10⁺⁴ до 0,48 • 10⁺³ мкпз. При испарении 1 л жидкости образуется 784,0 л газа.
Твердое состояние (кристаллизуется в гранецентрированную кубическую решетку с периодом а = 5,318А при т-ре 20 К): плотность в интервале т-р 15—48 К изменяется от 1,770 до 1,717 г/см³.
Теплофизические св-ва твердого аргона исследовались гл. обр. по кривой равновесия кристалл — пар.
Теплоемкость (при пост, объеме) в этом же интервале т-р изменяется от 5,04 до 1,91 кал/моль • град и (при пост, давлении) от 5,90 до 1,94 кал/моль • град.
Т-ра Дебая 93,3 К. Температурный коэфф. объемного расширения в интервале т-р 48—15 К уменьшается от 12,34• 10⁻⁴ до 3,96 • 10 ⁻⁴ град⁻¹.
Макс, прочность на разрыв твердого А. 160 г/мм² (т-ра 40 К); твердость (т-ра 20° С) 370 г/мм².
Потенциал ионизации (эв): V1 = 15,69; V2 = 27,60; V3 = 40,70. А. не образует валентных соединений с каким-либо др. элементом.
Однако известны молекулярные (клатратные) соединения аргона, в которых его атом связав с др. атомами Вандер-Ваальса силами. Наиболее полно изучен кристаллогидрат Аr • 6Н2O.
Электронная конфигурация аргона:
[Ne] 3s23p6,
полная электронная конфигурация аргона 1s22s22p63s23p6
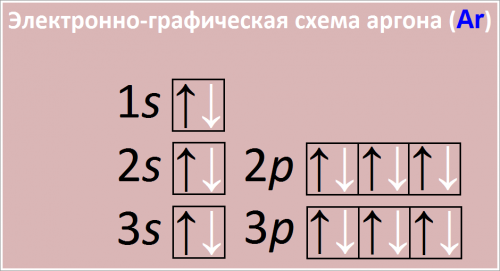
Рис. Схема распределения электронов по атомным орбиталям в атоме аргона.
Химические свойства
Благородный газ аргон химически неактивен. В редких случаях и в экстремальных условиях он образует слабые, похожие на соединения структуры.
Изотопы аргона
Искусственные радиоактивные изотопы, например 35Аr, 37Аr и 39Аr с периодами полураспада соответственно 1, 88 сек, 34 дня и 265 лет.
В природе аргон встречается только в свободном виде. Объемная концентрация его в воздухе — 0, 93% или объемная доля аргона в воздухе 0, 9%.
Преобладание тяжелого изотопа 40Аr связано с его образованием при радиоактивном распаде одного из самых распространенных элементов — калия (40К).
3 изотопа аргона существуют в природе. Этими изотопами являются аргон-36, Аргон-38 и аргон-40.
Изотопы образуют два или более из одного элемента. Изотопы отличаются друг от друга в зависимости от их массового числа.
Массовое число записывается справа от названия элемента — это массовое число. Массовое число представлено числом протонов плюс нейтронов в ядре атома элемента.
Количество протонов определяет элемент, но количество нейтронов в атоме любого одного элемента может варьироваться.
Каждое изменение представляет собой изотопный элемент.
Радиоактивный изотоп — это тот, который распадается на части и выделяет ту или иную форму излучения.
Радиоактивные изотопы образуются, когда мелкие частицы выстреливают в атомы. Эти частицы застревают в атомах и превращают их в радиоактивный элемент.
Никакие радиоактивные изотопы аргона не имеют никакого практического назначения.
Однако один нерадиоактивный изотоп можно использовать для определения возраста очень старых пород.
Получение аргона
В промышленности аргон получают в процессе разделения воздуха на азот и кислород при глубоком охлаждении.
От примесей азота аргон очищают дополнительной ректификацией, а от примесей кислорода — химическим методами.
Аргон может быть получен также как побочный продукт из продувочных газов колонны синтеза аммиака.
Аргон получают вместе с другими инертными газами из воздуха, где его содержание составляет 0,934% по объему. Кроме того, аргон образуется в калий содержащих минералах при £-захвате изотопа 40К.
При фракционировании воздуха возникает проблема отделения неона от аргона.
Одним из методов решения такой задачи является использование способности аргона образовывать молекулярные соединения включения — клатраты.
Неон не способен их образовывать из-за малого размера и ничтожной поляризуемости.
Аргон также может встречаться в скважинах с природным газом.
Когда природный газ очищается, некоторое количество аргона может быть извлечено в качестве побочного продукта реакции
Применение
Аргон используют в металлургических и химических процессах, протекающих в инертной среде, в частности при аргоно-дуговой пайке и резке алюминиевых и алюминиевых сплавов.
В термической обработке легко окисляющихся металлов, получении урана, плутония, бериллия, тория, циркония и драгоценных металлов, для выращивания в его среде кристаллов полупроводниковых материалов.
Аргон применяют также в:
- Светотехнике (в флюоресцентных лампах, лампах накаливания, разрядных трубках).
- Электронике (например, в тиратронах).
- В ядерной технике (в ионизационных счетчиках и камерах).
- В газовых лазерах, широко используемых в цветном телевидении, объемной фотографии.
- Космической связи.
Аргон используют в вольфрамовых лампах накаливания, чтобы снизить скорость испарения вольфрама из нити.
И кроме того, обеспечить концентрирование паров вольфрама к небольшому участку внутренней поверхности лампы.
Часто приходится видеть, как черные пятна на радиолампах возникают на одном небольшом участке стекла.
В этом применении используется не активность аргона и его ничтожная теплопроводность.
В газоразрядных трубках, наполненных аргоном, возникает голубое свечение. Это широко используется для создания световых реклам. Аргон используется для создания инертной атмосферы.
В больших количествах его расходуют при приготовлении специальных сплавов (например, сплавов магния) или при работе с чрезвычайно неустойчивыми и реакционно способными веществами.
Существует особый вид дуговой сварки, когда с целью защиты шва от воздуха ее проводят в атмосфере аргона.
Этот элемент занимает особое положение как среди 3-го периода, так и среди своих соседей по нулевой группе.
Как член 3-го периода, он должен обладать вакантными 3-орбиталями, в то же время разница в энергиях 3р- и З-состояний настолько велика, что использование для химической связи З-орбитали не дает сколько-нибудь заметного выигрыша энергии.
До сих пор не обнаружено ни одного молекулярного соединения аргона.
Потенциал ионизации аргона, хотя и меньше, чем у гелия и неона, но все-таки очень высок и равен 15,76 эВ. При возбуждении электронов и переводе их на 45-подуровень требуется 11,5 эВ.
Эти величины доказывают, насколько прочно ядро удерживает электроны внешнего октета.
О стабильности электронной конфигурации аргона в сравнении с электронной оболочкой элемента предыдущего периода неона можно судить, сопоставляя с ним изоэлектронных аргону анионов S²߫, С¹߫.
Эти ионы легче поляризуются, чем О²߫, F߫, и из-за больших размеров чаще могут быть восстановителями.
Для химии аргона важно учитывать относительно большой размер его атома 1,92 А и способность к поляризации.
Свойства простого вещества и соединений
Вещество аргон — бесцветный газ, почти в 1,5 раза тяжелее воздуха. Масса 1 л при нормальных условиях 1,7809 г.
Соединений с валентными связями от аргона ожидать трудно, но молекулярные соединения включения известны: клатраты с фенолом, толуолом и др.
Установлено, что координационное число аргона соответствует максимальному координационному числу всех элементов 3-го периода и равно шести.
Гидрат аргона Аr · 6Н2О — кристаллическое вещество, способное существовать ниже — 43° С.
Силы, возникающие между одноатомными молекулами этого благородного газа, достаточно велики. Уже при температуре жидкого азота (—196° С) аргон становится твердым веществом (tпл = —189° С, tкип = —186° С).
Небольшая разница температур плавления и кипения указывает на слабость межмолекулярных сил и подтверждается небольшим значением теплоты парообразования (6,27 кДж/моль).
Эта величина свидетельствует, что атомы связаны силами Вандер-Ваальса.
Воздействие на здоровье
Известно, что аргон не оказывает никакого положительного или отрицательного воздействия на здоровье растений, животных и людей.
Литература
Финкелыптейн Д. Н. Инертные газы. М., Ссылки: Аргон на земле и во вселенной, Аргон история.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.