Теллур это химический элемент, простое вещество, с блестящим металлическим блеском, в природе встречаеться восемь изотопов шесть из них, 120Te, 122Te, 123Te, 124Te, 125Te и 126Te — стабильны. Два — 128Te и 130Te — радиоактивны.
Минералы содержащие теллур: алтаит PbTe, сильванит AgAuTe4, калаверит AuTe2, тетрадимит Bi2Te2S, а также кислородные соединения теллура, например ТеО2 — теллуровая охра.
Название получил от Земля, родительный падеж telluris. Применяется как материал в производстве радиодеталей, в изготовлении оптических дисков и т.д.
Что такое теллур
[Tellurium; от лат. tellus (telluris) — Земля], Те — химический элемент 16-й группы (устаревший VI группы периодической системы элементов).
Атомный номер 52, атомная масса 127,60.
Блестящее серебристо-серое хрупкое вещество с металлическим блеском.
В соединениях проявляет степени окисления —2, +4 и +6.
Физические свойства теллура
Кристаллическая решетка гексагональная с периодами а — 4,4570 А и с = 5,9290 А. Плотность (т-pa 20р С) 6,22 г/см3; tпл 449,5° С; tкип 990±2° С.
Известна «аморфная» модификация теллура (порошок темно-коричневого цвета), необратимо переходящая в кристаллическую при нагревании.
Температурный коэфф. линейного расширения поликристаллического Т. (16—17) 10-6 град-1,у коэфф. теплопроводности (т-ра 20° С) 0,014 кал/см X сек х град; удельная теплоемкость (т-ра 25° С) 0,048 кал/г х град.
Теллур — полупроводник с шириной запрещенной зоны 0,34 эв. Электропроводность зависит от чистоты и степени совершенства кристалла.
В наиболее чистых образцах она равна ~0,02 ом-1 х см-1. Подвижность электронов 1700, подвижность дырок 1200 см2/в х сек.
При плавлении теллур переходит в металлическое состояние.
Теллур диамагнитен, удельная магнитная восприимчивость — 0,3 • 10-6-6 см3/г (при комнатной т-ре).
Твердость по шкале Мооса 2,0—2,5; ср. микротвердость 58 кгс/мм2 , модуль норм, упругости 4200 кгс/мм2, коэфф. сжимаемости (т-ра 30° С) 1,5-10 6 см2/кгс.
Монокристаллы теллура с ориентацией по (0001) хрупко разрушаются при напряжении 14 кгс/мм2.
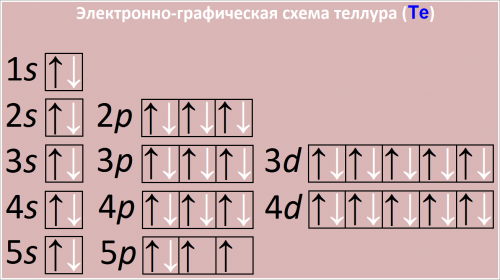
Полная электронная формула атома теллура в порядке следования уровней:
1s2 2s2 2p6 3s2 p6 3d10 4s2 4p6 4d10 5s2 5p4
Сокращенная электронная конфигурация Te:
[Kr] 4d10 5s2 5p4
Химические свойства теллура
По химическим свойствам теллур напоминает серу и селен, но менее активен.
При комнатной т-ре не окисляется на воздухе, при нагревании сгорает с образованием двуокиси ТеО2 — белого кристаллического вещества, мало растворимого в воде.
Известны также окислы ТеО и ТеО3, менее устойчивые, чем ТеО2.
При обычных условиях очень медленно взаимодействует с водой с выделением водорода и образованием селеновой кислоты.
С серной кислотой H2SO4 с образованием раствора TeSО3 красного цвета; при разбавлении водой протекает обратная реакция с выделением теллура.
Растворяется в азотной кислоте HNO3 с образованием теллуристой к-ты Н2ТеО3, в разбавленной соляной к-те растворяется слабо.
В щелочах теллур растворяется медленно.
С водородом образует теллуристый водород Н2Те — бесцветный газ с неприятным запахом, конденсирующийся при т-ре —2° С и затвердевающий при т-ре —51,2° С,
Н2Те нестойкое соединение, легко разлагающееся под действием даже слабых окислителей.
Стабильных при обычных условиях сульфидов не образует, соединение TeS2 устойчиво при т-ре до —20° С. С селеном образует непрерывные твердые растворы.
Известны галогениды состава ТеХ (только фторид), ТеХ4 и ТеХ2, к-рые получают непосредственным взаимодействием элементов.
При комнатной т-ре все галогениды — твердые вещества, частично разлагающиеся водой; только TeFe — бесцветный газ с неприятным запахом.
При нагревании теллур реагирует со многими металлами, образуя теллуриды.
Он горит на воздухе (зеленовато — синим), образуя соответствующие оксиды TeO2.
В отличие от SO2 оксид теллура является кристаллическим веществом и плохо растворим в воде.
Непосредственно с водородом не соединяется.
При нагревании взаимодействует с многими металлами, образуя соответствующие соли (теллуриды), например K2Te.
Теллур даже при обычных условиях реагирует с водой:
Te + 2H2O = TeO2 + 2H2
Сера, селен, теллур окисляется до соответствующих кислот H2TeO4, но при более жестких условиях и действии других окислителей:
Te + 3H2O2 (30%) = H6TeO6
В кипящих водных растворах щелочей теллур, подобно сере, медленно растворяется:
3Te + 6KOH = 6K2Te + K2TeO3 + 3H2O
Теллур употребляется главным образом, как полупроводниковый материал.
Теллур восстанавливается из оксидов TeO2 при действии на них сернистого газа в водной среде:
TeO2 + H2O = H2TeO3
H2SeO3 + 2SO2 + H2O = Se + 2H2SO4
Теллур, как и селен, образует аллотропические модификации — кристаллический и аморфный (аллотропия теллура).
Кристаллический теллур — серебристо — серого цвета, хрупок, легко растирается в порошок. Его электропроводность незначительна, но при освещении увеличивается.
Аморфный теллур — коричневого цвета, менее устойчив, чем аморфный селен и при 25 град. переходит в кристаллический.
Изотопы
Природный состоит из восьми стабильных изотопов с массовыми числами 120Те,122Те — 126Те, 128Те и 130Те.
Известны 16 радиоактивных изотопов с периодом полураспада от 2 до 154 дней. Наиболее распространены тяжелые изотопы с массовыми числами 128Те и 130Те.
Теллур открыл (1782) венг. исследователь Ф. Мюллер фон Рейхенштейн.
Получение теллура
Сырьем для получения теллура служат шламы медноникелевого и сернокислотного произ-ва, а также продукты, получаемые при рафинировании свинца.
Анодные шламы перерабатывают кислотным или щелочным способом, переводя вещество в четырехвалентное состояние.
И затем восстанавливая его сернистым газом из растворов в концентрированной соляной к-те либо электролитически.
Кроме того, материалы, можно перерабатывать хлорным методом.
Теллур высокой чистоты получают сублимацией и зонной перекристаллизацией (наиболее эффективный способ глубокой очистки, позволяющий получать вещество чистотой 99,9999%).
Применение
Применяют при вулканизации каучука, в произ-ве свинцовых кабелей (добавка до 0,1% Те улучшает мех. св-ва свинца).
Соединения используют в стекольной пром-сти (для окраски стекла и фарфора) и в фотографии.
Широкое применение получил в синтезе полупроводниковых соединений. Соединения основной материал для произ-ва термоэлементов.
Нахождение в природе
Теллур относится к рассеянным элементам (содержание их в земной коре составляет 1 ⋅ 10⁻⁷ %).
Теллур редко образует самостоятельные минералы .
Обычно он встречается в природе в виде примесей к сульфидам, а также в самородной сере.
Основными источниками теллура и селена служат отходы сернокислого производства.
Накапливающиеся в пылевых камерах, а также осадки (шламы), образующиеся при электролитической очистке меди.
В шламе, в числе других примесей, содержится также селенид серебра Ag2Se и некоторые теллуриды.
При обжиге шлама образуются оксид теллура TeO2, а также оксиды тяжёлых металлов.
Свойства теллура
Теллуроводород может быть получен действием на теллуриды разбавленными кислотами:
Na2Te + H2SO4 = Na2SO4 + H2Te
Теллуроводород при нормальных условиях представляет собой бесцветный газ с характерными неприятными запахами.
Более неприятный чем запах H2S, но сероводород более ядовит, а теллуроводород менее ядовит.
Теллур можно определить химическим анализом, например Бутилродамин С (БРС), Тиомочевина (ТМ) и др.
Гидриды теллура проявляют восстановительные свойства в большей степени, чем сероводород, а растворимость H2Te в воде примерно такая же как и у сероводорода.
Водные растворы гидридов обнаруживают явно выраженную кислую реакцию вследствие диссоциации их в водных растворах по схеме :
H2Te ↔ H + HTe⁺
↓
H + Te²⁺
В ряду O — S — Se — Te радиусы их ионов Э²⁺ удерживать ион водорода.
Это подтверждается опытными данными , что подтвердило теллуроводородная кислота является более сильной чем сероводородная кислота.
В ряду O — S — Se — Te способность к термической диссоциации гидридов увеличивается: труднее всего разложить воду при нагревании, а гидриды теллура неустойчивы и разлагается даже при слабом нагревании.
Соль теллуроводородной кислоты (теллуриды) по своим свойствам близки к сульфидам. Их получают подобно сульфидам , действием теллурводорода на растворимые соли металлов.
Теллуриды сходен с сульфидами в отношении растворимости в воде и в кислотах.
Например, при пропускании теллурводорода через водный раствор Cu2SO4 получается теллурид меди :
H2Te + CuSO4 = H2SO4 + CuTe
Кислородные соединения
С кислородом Te образует соединения TeO2 и TeO3 они образуются при сгорании теллура на воздухе, при обжиге теллуридов , также при сжигании гидридов теллура:
Te + O2 = TeO2
2ZnTe + 3O2 = 2ZnO + 2TeO2
2H2Te + 3O2 = 2H2O + 2TeO2
TeO2 — кислотные оксиды (ангидриды).
При растворении в воде образуют, соответственно, теллуристую кислоту:
TeO2 + H2O = H2TeO3
Эта кислота диссоциирует в водном растворе несколько слабее, чем сернистая кислота.
Теллуристая кислота в свободном виде не получена и существует только в водных растворах.
В то время как соединения серы со степенью окисления 4+ в химических реакциях преимущественно выступают в качестве восстановителей, с повышением степени окисления серы до 6 +.
Теллуристая кислота
TeO2 и соответствующие им кислоты проявляют главным образом окислительные свойства, восстанавливаясь соответственно до Te.
Эти способом на практике получают теллур в свободном виде:
H2TeO3 + 2SO2 + H2O = 2H2SO4 + Te
Восстановительные свойства теллуристая кислота проявляет лишь при взаимодействии с сильными окислителями :
3H2TeO3 + HClO3 = 3H2TeO4 + HCl
Свободная теллуровая кислота H2TeO4 — обычно выделяется в виде кристаллогидрата H2TeO4 • 2H2O которую записывают как H6TeO6.
В ортотеллурной кислоте H6TeO6 атомы водорода способны частично или полностью замещаться атомами металлов , образуя соли Na6TeO6 .
Теллуровая кислота
Теллуровая кислота это бесцветная кристаллическое вещество , хорошо растворимое в воде , она по своим свойствам весьма слабая как кислота .
Окислительные свойства у неё выражены сильнее чем у серной кислоты.
Теллуровая кислота окисляет соляную кислоту HCl по реакции:
H2ТeO4 + 2HCl = H2ТeO3 + H2O + Cl2
Ангидриды теллуровой кислоты TeO3 получают различными путями.
Оксид теллура (IV)
Оксид теллура (IV) образуется при нагревании теллуровой кислоты до 300°C (при более сильном нагревании TeO3 разлагается на TeO2 и O2):
H2TeO4 (300°C) → TeO3 + H2O
2TeO3 (>300°C)→ 2TeO2 + O2
TeO3 — порошок желтоватого цвета, не растворяется ни в воде, ни в разбавленных растворах кислот и щелочей, а только в концентрированных водных растворах щелочей:
TeO3 + 2KOH = K2TeO4 + H2O
Соединения теллура
Соединения теллура токсичны, их действие на организм человека подобно действию соединений селена и мышьяка.
Наиболее сильным ядом является теллуристый водород.
Предельно допустимая концентрация в воздухе 0,01 мг/мв.
Пожаро — взрывоопасность
Te — теллур, горючее вещество. Атомная масса 127,6; температура плавления 449,8°C. Дисперсность образца менее 44 мкм . Темп. самовоспл : аэрогеля 340°C , аэровзвеси 550°C .
TeH2 — теллуроводород, горючий газ. Мол. масса 129, 62; плотн. сжиженного газа 2570кг/ м³ при температуре — 20°C ; плавление — 51°C ; тимп. кипения от -2 до -3°C ; плотность по воздуху 4,49 ; в воде растворим но неустойчив ; идёт разложение телуроводорода на элементы.
Часто задаваемые вопросы ответы о теллуре?
Теллур металл или неметалл?
Не металл, но при плавлении теллур переходит в металлическое состояние.
Расположите химические элементы в порядке усиления неметаллических свойств теллур сера селен?
Неметаллические свойства простых веществ элементов усиливаются при движении снизу вверх, поэтому последовательность элементов в порядке усиления неметаллических свойств соответствующих им простых веществ следующая: теллур — селен — сера.
Какие степени окисления у теллура?
В химических соединениях теллур проявляет степени окисления −2; +2; +4; +6. Является аналогом серы и селена, но химически менее активен, чем сера.
Для чего используют теллур?
Теллур применяется в производстве сплавов свинца с повышенной пластичностью и прочностью (применяемых, например, при производстве кабелей).
При введении 0,05 % теллура потери свинца на растворение под воздействием серной кислоты снижаются в 10 раз, и это используется при производстве свинцово-кислотных аккумуляторов.
Где содержится теллур?
Содержание в земной коре 1·10-6 % по массе. Известно около 100 минералов теллура. Важнейшие из них: алтаит PbTe, сильванит AgAuTe4, калаверит AuTe2, тетрадимит Bi2Te2S. Встречаются кислородные соединения теллура, например ТеО2 — теллуровая охра.
Где открыли теллур?
В январе 1798 г. он выступил с сообщением перед Берлинской академией наук об открытии им в трансильванском «белом золоте» особого металла, который получен «от матери земли» и назван поэтому теллуром (Tellur) от слова tellus земля (планета).
Почему теллур так называется?
И только в 1798 году немецкий химик Мартин Клапрот выделил новый элемент в чистом виде, определив его важнейшие свойства.
По его предложению элемент назвали tellurium (от лат. tellus – Земля, родительный падеж telluris) с символом Te. В русском языке закрепился термин «теллур».


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.