Теория:
Валентность — это фундаментальное свойство атома, которое определяет его способность образовывать определённое число химических связей с другими атомами.
Проще говоря, это «сила» атома присоединять к себе другие атомы.
Способность атома к образованию связей напрямую зависит от его электронного строения, а именно от количества и расположения электронов на внешнем (валентном) энергетическом уровне.
Именно эти валентные электроны взаимодействуют с электронами других атомов, чтобы достичь более стабильного и энергетически выгодного состояния.
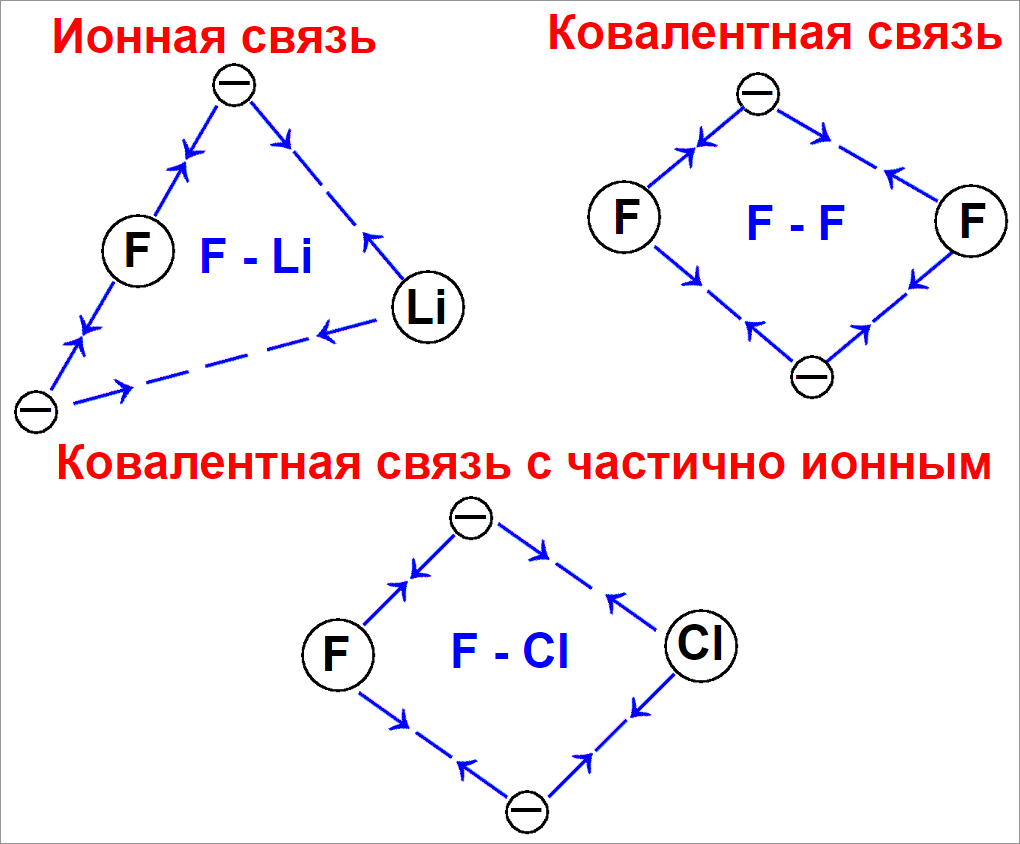
Как определить валентность химических элементов
Определить валентность химического элемента можно несколькими проверенными способами.
Понимание каждого из них позволит вам глубже разобраться в химических свойствах различных веществ.
Основные методы:
✅По положению в Периодической таблице. Для элементов главных подгрупп (s— и p-элементов) номер группы часто указывает на высшую валентность.
Узнайте подробнее, как использовать Периодическую таблицу для определения валентности, в нашей отдельной статье.
✅По химической формуле соединения. Если валентность одного из элементов в соединении известна, то валентность другого можно рассчитать.
Освойте этот практический метод, прочитав наше пошаговое руководство по расчёту валентности по формуле.
✅По электронному строению атома. Валентность напрямую связана с количеством валентных электронов.
Мы детально разбираем, как электронная конфигурация атома влияет на его валентность, в отдельном материале.
✅По степени окисления. Хотя валентность и степень окисления — это разные понятия, они тесно связаны.
Разберитесь в различиях между валентностью и степенью окисления и научитесь определять валентность через этот показатель.
Пример определения валентности
Рассмотрим пример с Водородом (H), его валентность всегда равна I (единица).
Пример: Молекула воды (H2O) В молекуле воды один атом Кислорода (O), валентность которого II, связан с двумя атомами Водорода (H).
Поскольку Кислород образует две связи, а каждый атом Водорода может образовать только одну связь, два атома Водорода необходимы, чтобы «насытить» валентность Кислорода.
Это подтверждает, что валентность каждого атома Водорода — I.
Список валентностей различных веществ
Для более детального изучения валентности отдельных элементов, переходите по ссылкам на специализированные статьи:
- В. Водорода (Н)
- В. Гелия (Не)
- В. Лития (Li)
- В. Бериллия (Ве)
- В. Бора (B)
- В. Углерода (С)
- В. Азота (N)
- В. Кислорода (О)
- В. Фтора (F)
- В. Неона (Ne)
- В. Натрия (Na)
- В. Магния (Mg)
- В. Алюминия (Al)
- В. Кремния (Si)
- В. Фосфора (Р)
- В. Серы (S)
- В. Хлора (Cl)
- В. Аргона (Ar)
- В. Калия (К)
- В. Кальция (Са)
- В. Скандия (Sc)
- В. Титана (Ti)
- В. Ванадия (V)
- В. Хрома (Cr)
- В. Марганца (Mn)
- В. Железа (Fe)
- В. Кобальта (Co)
- В. Никеля (Ni)
- В. Меди (Cu)
- В. Цинка (Zn)
- В. Галлия (Ga)
- В. Германия (Ge)
- В. Мышьяка (As)
- В. Селена (Se)
- В. Брома (Br)
- В. Криптона (Kr)
- В. Рубидия (Rb)
- В. Стронция (Sr)
- В. Иттрия (Y)
- В. Циркония (Zr)
- В. Ниобия (Nb)
- В. Молибдена (Mo)
- В. Технеция (Tc)
- В. Рутения (Ru)
- В. Родия (Rh)
- В. Палладия (Pd)
- В. Серебра (Ag)
- В. Кадмия (Cd)
- В. Индия (In)
- В. Олова (Sn)
- В. Сурьмы (Sb)
- В. Теллура (Те)
- В. Йода (I)
- В. Ксенона (Xe)
- В. Цезия (Cs)
- В. Бария (Ba)
- В. Лантана (La)
- В. Церия (Ce)
- В. Празеодима (Pr)
- В. Неодима (Nd)
- В. Прометия (Pm)
- В. Самария (Sm)
- В. Европия (Eu)
- В. Гадолиния (Gd)
- В. Тербия (Tb)
- В. Диспрозия (Dy)
- В. Гольмия (Ho)
- В. Эрбия (Er)
- В. Тулия (Tm)
- В. Иттербия (Yb)
- В. Лютеция (Lu)
- В. Гафния (Hf)
- В. Тантала (Ta)
- В. Вольфрама (W)
- В. Рения (Re)
- В. Осмия (Os)
- В. Иридия (Ir)
- В. Платины (Pt)
- В. Золота (Au)
- В. Ртути (Hg)
- В. Таллия (Tl)
- В. Свинца (Pb)
- В. Висмута (Bi)
- В. Полония (Po)
- В. Астата (At)
- В. Радона (Rn)
- В. Франция (Fr)
- В. Радия (Ra)
- В. Актиния (Ac)
- В. Тория (Th)
- В. Протактиния (Pa)
- В. Урана (U)
- В. Нептуния (Np)
- В. Плутония (Pu)
- В. Америция (Am)
- В. Кюрия (Cm)
- В. Берклия (Bk)
- В. Калифорния (Cf)
- В. Эйнштейния (Es)
- В. Фермия (Fm)
- В. Менделевия (Md)
- В. Нобелия (No)
- В. Лоуренсия (Lr)
- В. Резерфордия (Rf)

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.