Теория:
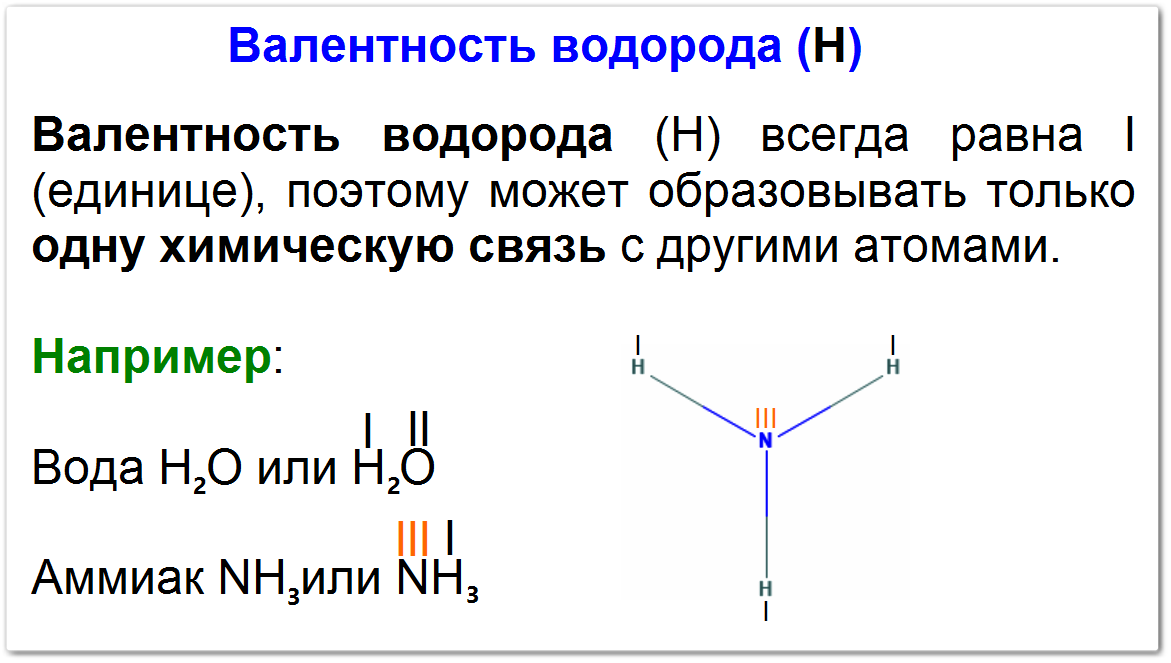
Валентность водорода — это постоянная валентность, равная I (единице).
Это означает, что атом водорода всегда способен образовывать только одну химическую связь с другим атомом.
Это связана с его электронным строением:
- Один валентный электрон.
- Стремление к стабильности (правило дублета).
Определяют или подтверждают эту постоянную валентность:
Положение в Периодической таблице.
Электронная конфигурация водорода.
Квантовые числа.
Валентность водорода (H) всегда равна I (единице). Это означает, что атом водорода способен образовывать только одну химическую связь с другим атомом.
Почему валентность водорода равна I? (Электронное строение)
Атомный номер водорода (Z) = 1.
Электронная конфигурация: 1s1.
Электроотрицательность водорода ≈ 2,20.
Атом водорода имеет один валентный электрон на своем единственном энергетическом уровне (1s-орбитали).
Для достижения стабильной электронной конфигурации, подобной ближайшему благородному газу гелию (1s2), атому водорода необходимо приобрести еще один электрон или обобществить свой единственный электрон с другим атомом.
Именно эта потребность в одном дополнительном электроне или одной связи обуславливает его валентность, равную I.
Орбитальная диаграмма атома водорода:

Примеры соединений, демонстрирующих валентность водорода I
Вода (H2O) или Н — О — Н , каждый атом водорода образует одну ковалентную связь с атомом кислорода.
Кислород, имея валентность II, связывается с двумя атомами водорода.
Хлороводород (HCl) или H − Cl, атом водорода образует одну ковалентную связь с атомом хлора. Хлор также одновалентен в данном соединении.
Аммиак (NH3), каждый из трех атомов водорода образует одну ковалентную связь с атомом азота. Азот проявляет валентность III.
Метан (CH4), каждый из четырех атомов водорода образует одну ковалентную связь с атомом углерода. Углерод проявляет валентность IV.
Гидрид натрия (NaH) или Na+[H]—, здесь водород присоединяет один электрон от натрия, образуя ионную связь. Валентность водорода (способность присоединить один атом натрия) остается I.
Почему водородная связь не является ионной связью
Водородная связь — это особый тип межмолекулярного взаимодействия (значительно слабее химической связи).
Которое возникает между атомом водорода, ковалентно связанным с сильно электроотрицательным атомом (обычно кислородом, азотом или фтором).
И другим электроотрицательным атомом, имеющим неподеленную электронную пару.
Почему водородная связь не ионная
✅Частичные заряды: В водородной связи участвуют атомы с частичными (δ+ и δ—) зарядами, возникающими из-за полярности ковалентной связи (например, в O — H).
В ионной связи участвуют полностью сформированные ионы с целыми зарядами (+1, -1, +2, -2 и т.д.).
✅Межмолекулярное взаимодействие: Водородная связь обычно образуется между разными молекулами (хотя может быть и внутри одной большой молекулы).
Ионная связь является внутримолекулярной силой, удерживающей ионы вместе в кристаллической решетке или формульной единице.
✅Энергия связи: Энергия водородной связи значительно ниже, чем энергия типичной ионной связи.
Водородные связи легко разрываются при небольшом повышении температуры, в то время как для разрушения ионных связей требуется гораздо больше энергии.
Пример решения:
Определите валентность фосфора (P) в молекуле фосфина (PH3).
Известно, что валентность водорода (H) всегда равна I.
Дано:
Молекула: Фосфин (PH3)
Валентность водорода (H) = I
Найти:
Валентность фосфора (P)
Решение:
В молекуле PH3 присутствует 3 атома водорода.
Поскольку валентность каждого атома водорода равна I, то «общая валентность», приходящаяся на водород в этой молекуле, равна 3 × I = III.
В бинарных соединениях (состоящих из двух элементов), таких как PH3, общая валентность одного элемента должна компенсироваться общей валентностью другого элемента.
Следовательно, единственный атом фосфора (P) должен проявлять валентность, равную III, чтобы компенсировать «общую валентность» трех атомов водорода.
Ответ: Валентность фосфора (P) в молекуле фосфина (PH3) равна III (трем).
Часто задаваемые вопросы
У водорода — это постоянная валентность, равная I (единице).
Потому, что при рассмотрении электронной формулы водорода (1s1), мы увидим, что он имеет на валентной орбитали всего лишь один электрон.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.