Что такое окислительно восстановительные реакции
Все окислительно восстановительные реакции можно разделить на три группы:
1. Реакции между атомного или между молекулярного окисления-восстановления,
2. Реакции самоокисления-самовосстановления
3. Реакции внутримолекулярного окисления-восстановления.
Рис. Углерод как восстановитель.
1. Реакции между атомного или между молекулярного окисления-восстановления. Сюда относятся такие реакции, в которых обмен электронами происходит между различными атомами, молекулами или ионами.
2. Реакции самоокисления-самовосстановления. Сюда относятся реакции, в которых обмен электронами происходит между двумя одинаковыми молекулами, атомами или ионами одного и того же вещества.
3. Реакции внутримолекулярного окисления-восстановления. Сюда относятся реакции, в которых переход электронов происходит внутри одной и той же молекулы.
Реакции окисления восстановления составление уравнений
Прежде чем перейти к составлению уравнений реакций окисления-восстановления, необходимо научиться определять валентность элемента в различных соединениях.
Здесь следует исходить из следующих положений:
1. Валентность некоторых элементов — величина постоянная. Так, например, натрий во всех соединениях одновалентен, цинк — двухвалентен, алюминий—трёхвалентен и т. д.
Валентность у целого ряда элементов изменяется в зависимости от условий протекающего процесса.
Например, олово может быть двух- и четырёхвалентным, медь одно- и двухвалентной, сера — двух-, четырёх- и шестивалентной. Валентность элементов изменяется от —4 до +8.
Она очень часто определяется группой периодической системы Д. И. Менделеева, в которой находится данный элемент.
Для каждого элемента существует максимальная валентность. Для хлора она равна 7, для азота 5, свинца 4 и т. д.
2. Валентность элементов в соединении определяется количеством электронов, теряемых или приобретаемых атомами при образовании молекул.
Валентность элемента в соединении равна числу положительных или отрицательных зарядов иона.
Положительную валентность проявляют те элементы, которые при образовании данной молекулы потеряли свои электроны; отрицательную валентность проявляют элементы, принявшие электроны.
Один и тот же элемент в зависимости от того, с каким элементом и при каких условиях он вступает в реакцию, может проявлять или положительную, или отрицательную валентность.
Так, например, хлор в соединениях КCl и НСl отрицательно одновалентен, а в молекулах Сl2O и Сl2O7 он одно- и семиположительно валентен.
Металлы в соединениях почти всегда проявляют положительную валентность. Водород положительно одновалентен ). Кислород отрицательно двухвалентен.
Валентность по кислороду меняется от 1 до 8 (Na2O, OsO4), а по водороду — от 1 до 4 (HBr, SiH4).
Алгебраическая сумма положительной и отрицательной валентности атомов (ионов), составляющих молекулу, равна нулю. Валентность атомов свободных элементов также равна нулю.
Определим валентность хлора в бертолетовой соли КСlO3.
Согласно вышеизложенному рассуждению можно написать: валентность атома (иона) калия +1, количество единиц валентности трёх атомов кислорода — 6.
Так как сумма положительной и отрицательной валентности в молекуле КСlO3 одинакова, то валентность атома хлора здесь + 5.
Обозначим валентность хлора через х.
Составим уравнение:
1+x+3 • (—2) = 0;
1 + х—6 = 0,
откуда
х= + 5.
Изменение валентности элементов
Валентность элементов в процессе окислительно-восстановительной реакции изменяется.
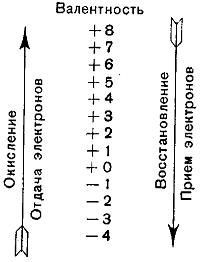
В приведённой реакции Zn — 2ē → Zn (окислился), Se + 2ē = Se (восстановился). Графическое изображение
изменения валентности в результате окислительно-восстановительных реакций дано на рис. 1.
На средней линии графика обозначена валентность от — 4 до +8.
Валентность в зависимости от условий реакции может изменяться снизу вверх (по направлению левой стрелки) и сверху вниз (по направлению правой стрелки).
Допустим, что валентность у элементов до реакций была соответственно 0 (Na), —2 (S) и —3 (N), а в результате реакций стала+1 (Na), 0 (S) и + 2 (N). Что произошло?
Произошли окислительно-восстановительные реакции, в результате которых электронейтральный атом натрия отдал 1 ē и превратился в положительно валентный ион натрия:
Na0 —lē → Na (+1),
отрицательно валентный ион серы отдал 2ē и превратился в электронейтральный атом серы: S(-2) — 2ē → S(0);
трёх отрицательно валентный ион азота потерял 5ē и перешёл в двух положительно валентные ион азота
N(-3) —5ē → N(+2).
На основании вышеизложенного можно сделать заключение; при окислении атома или иона валентность всегда повышается.
Так, например, если по графику валентность повышается от 0 до + 1, то это значит, что происходит отдача одного электрона, при повышении валентности от 0 до +2 или от +3 до +6 отдаются соответственно два и три электрона.
Напротив, при восстановлении валентность всегда понижается.
При понижении валентности по графику от 0 до — 1 или от 0 до — 2, или от + 7 до + 2 происходит соответственно приём одного, двух или пяти электронов.
Все окислительно-восстановительные реакции для удобства составления уравнений можно разделить на две группы:
1. Реакции, в которых принимают участие атомы, молекулы и ионы простых веществ: Na(0), Na•, Cl2, Cl‘ , Сu(0), Сu•• ;
2. Реакции, в которых принимают участие, как правило, сложные анионы: NO‘3, SO»4, СrO»4, МnO‘4 и др.
Простейшие реакции
При составлении уравнения окислительно-восстановительной реакции необходимо определить:
1. Валентность (или зарядность) атомов и ионов, участвующих в реакции;
2. Восстановитель и окислитель
3. Число отдаваемых и принимаемых ими электронов.
Число электронов, отдаваемых восстановителем и принимаемых окислителем, определяется изменением валентности (или зарядности) атомов и ионов до и после реакции.
Коэффициенты в уравнениях для восстановителя и окислителя находятся по правилу:
Общее число электронов, отданных восстановителем, должно равняться общему числу электронов, принятых окислителем.
При составлении уравнений реакций окисления-восстановления необходимо знать химические формулы как вступающих в реакцию веществ, так и получающихся продуктов.
Вещества, получающиеся в результате реакции, могут быть установлены либо специальным исследованием, либо прямо на основании известных свойств реагирующих веществ.
Пример реакции окисления алюминия кислородом
1) Пишем формулы исходных и полученных веществ (на первом месте восстановитель, на втором—окислитель):
Аl + O2 → Аl2O3.
2) Находим валентность элементов до и после реакции
Аl(0) + O2(0) → Аl2(+3)O3(-2)
3) Находим число электронов, отдаваемых восстановителем и присоединяемых окислителем:
Аl + O2→Аl2O3.
4) Находим коэффициенты для восстановителя и окислителя. Для этого число, стоящее под окислителем, ставим перед восстановителем, а число, стоящее под восстановителем, ставим перед окислителем:
4Аl+3O2 →Аl2O3.
5) Производим проверку числа атомов каждого элемента в исходных и полученных веществах реакции и расставляем соответствующие коэффициенты:
4Аl(0) + 3O2(0) = 2Аl2(+3)O3(-2)
6) Проверяем правильность составления уравнения путём подсчёта атомов каждого элемента в обеих частях уравнения.
Убеждаемся, что оно написано верно, так как число исходных и полученных элементов равно.
При некотором навыке не понадобится переписывать уравнение несколько раз и все вышеуказанные операции можно производить в одном и том же уравнении.
Составление уравнений реакций окисления-восстановления с участием среды
При составлении уравнений реакций окисления-восстановления необходимо помнить, что эти процессы зависят от характера среды, в которой они протекают.
Нередко окислитель или восстановитель проявляют свои характерные свойства только в определённой среде: кислой, щелочной или нейтральной.
От среды зависит скорость реакции. В некоторых случаях среда изменяет даже направление процесса.
Например:
в щелочной среде →
3J2 + 3H2O ⇄ HJО3 + 5HJ или 3J2 + 3Н2О ⇄ 6Н + JO‘3 + 5J‘
в кислой среде ←
В данном случае щелочная среда благоприятствует течению процесса слева направо, т. е. в сторону образования HJO3 и HJ.
Так как избыток гидроксильных ионов ОН‘, соединяясь с ионами водорода, образует практически не диссоциированные молекулы воды, кислая же среда сдвигает равновесие реакции справа налево.
То есть в сторону образования Н2O и J2, так как ионы водорода с ионами кислорода в кислой среде образуют почти не диссоциированные молекулы воды.
Для создания в растворе кислой среды обычно пользуются серной кислотой.
Соляная кислота и азотная применяются реже, так как первая способна, проявляя восстановительные свойства, окисляться.
А вторая сама является сильным окислителем и потому может вызывать дополнительные, побочные процессы.
Для создания щелочной среды применяются главным образом NaOH или КОН.
Приступая к составлению уравнения реакций с участием среды, следует так же, как и в уравнениях простейших реакций, написать исходные и образующиеся вещества.
На первом месте восстановитель, на втором—окислитель, а на третьем — вещества, создающие определённую среду: кислоту, щёлочь или воду, затем найти коэффициенты.
При написании уравнений этих реакций необходимо иметь в виду следующее:
1. Освобождающиеся при реакции ионы кислорода в кислой среде с ионами водорода образуют почти не диссоциированные молекулы воды, а в нейтральной или щелочной среде — гидроксильные группы.
2. Ионы водорода с ионами гидроксила в щелочной среде образуют молекулы воды.
3. В процессе реакции могут образоваться сложные и простые ионы типа:
Э+2, Э+8, Э-1 и т. д.
Об окончании окислительно-восстановительной реакции судят по изменению цвета, выпадению осадка, по выделению газообразного продукта и т. д.
Например, красно-фиолетовый МnO4 при переходе в Мn(+2) становится бледно-розовым (почти бесцветным), оранжево-красный Сr2O7, при переходе в Сr+3 становится зеленым. Реакция
2H2S + SO2= ↓3S + 2H2O
сопровождается выпадением осадка серы. Реакция
Zn + H2SO4 = ↑ H2 + ZnSO4 сопровождается выделением газа — водорода.
Реакции в кислой среде
I. Составим уравнение реакции сернистокислого натрия (сульфита натрия) с марганцовокислым калием (перманганатом калия) в кислой среде, придерживаясь следующей последовательности.
1) Напишем формулы исходных и полученных веществ: Na2SO3 + KMnO4+H2SO4 → Na2SO4 + K2SO4 + MnSO4+H2O.
2) Определим:
а) валентность участвующих в реакции элементов (серы и марганца),
б) восстановитель и окислитель и в) необходимые коэффициенты для них.
В молекуле Na2SO3 ион SO3(S)—восстановитель, он отдаёт два электрона и переходит в ион SO4(S). В моле-куле КМnO4 ион МnO4(Мn) — окислитель; он в кислой среде принимает пять электронов и переходит в ион Мn. Поставим под восстановителем число 2, а под окислителем — число 5.
Находим коэффициенты для восстановителя и окислителя. Дли этого число 2, стоящее под восстановителем, поставим перед окислителем, а число 5, стоящее под окислителем,
Поставим перед восстановителем:
5Na2SO3 + 2KMnO4 + H2SO4 → 5Na2SO4 + K2SO4 + 2MnSO4 + H2O.
3) По числу кислотных остатков в правой части уравнения находим коэффициент для кислоты. В результате реакции получается восемь кислотных остатков S04, из них 5S04 на счёт окислительно-восстановительного процесса (превращения 5SO»3 → 5SO»4), a 3SO»4 за счёт молекул серной кислоты (8SO«4 — 5SO«4 = 3SO«4).
Таким образом, серной кислоты необходимо взять три молекулы:
5Na2SO3 + 2КМnO4 + 3H2SO4 → 5Na2SO4 + K2SO4 + 2MnSO4 + Н2O.
4) По числу ионов водорода (6Н•) в левой части уравнения находим коэффициент для воды. Уравнение примет окончательный вид:
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + K2SO4 + 2MnSO4 + 3H2O.
Признаком правильности подбора коэффициентов является одинаковое количество атомов каждого элемента в обеих частях уравнения.
Разумеется, и в данном случае нет необходимости переписывать реакцию несколько раз и все вышеуказанные операции следует производить с одним и тем же уравнением (в уме).
II. Если восстановителем является отрицательно заряженный ион галогена, а окислителем положительно заряженный ион того же галогена, то последний восстанавливается до нейтральной молекулы.
Например:
5NaBr + NaBrO3 + 3H2SO4 = 3Вr2 + 3Na2SO4 + 3H2O.
III. Составим уравнение реакции окисления сульфида меди азотной кислотой. Азотная кислота, особенно концентрированная, является довольно сильным окислителем.
Сущность окисления различных веществ азотной кислотой состоит в том, что пяти положительно валентный ион азота, входящий в состав аниона.
Может в зависимости от условий (концентрации кислоты, природы восстановителя, температуры) принимать от одного до восьми электронов.
Металлы, находящиеся в таблице окислительно-восстановительных потенциалов ниже водорода, окисляются разбавленной HNO3 с выделением NO, а концентрированной — с выделением NO2.
Более энергичные металлы, такие, как цинк, кальций и другие, восстанавливают HNO3 до N2O; эти металлы весьма разбавленную HNO3 восстанавливают до образования аммонийных солей.
Железо, никель, кобальт и другие металлы, обладающие средней активностью, сильно разбавленную HNO3 восстанавливают до NO и даже (кобальт) до N2.
Золото, платину, иридий, родий, ниобий, тантал, вольфрам и другие металлы — азотная кислота не окисляет.
Неметаллы (большинство) восстанавливают HNO3 до NO.
Чтобы восстановление азотной кислоты шло как можно дальше, необходимо брать наиболее разбавленную кислоту, применять сильный восстановитель и реакцию вести на холоду.
Чем азотная кислота концентрированнее, а восстановитель слабее, тем азотная кислота восстанавливается меньше.
Это объясняется тем, что концентрированная HNO3 окисляет низшие продукты восстановления в высшие.
Так, например, NO окисляется концентрированной HNO3 до NO2; NO2, реагируя c водой, даёт NO и HNO3:
NO + 2HNO3 ⇄ 3NO2+H2O.
Ознакомившись с окислительными свойствами HNO3, составим уравнения реакций окисления CuS разбавленной и концентрированной HNO3 при нагревании:
3CuS + 8HNO3 = 3S + 3Cu(NO3)2 + 2NO + 4H2O.
Реакции в щелочной среде
Составим уравнение реакции сернистокислого натрия с марганцовистокислым калием в сильно щелочной среде и недостатке восстановителя.
Соблюдая последовательность, аналогичную разобранным выше примерам в кислой среде.
1) Напишем в левой части уравнения формулы исходных и образующихся веществ:
Na2SO3 + KMnO4+KOH → Na2SO4 + K2MnO4 + Н2O.
2) Определим:
а) валентность участвующих в реакции элементов,
б) восстановитель и окислитель,
в) необходимые коэффициенты для них:
В молекуле Na2SО3 ион SО3 (S) является восстановителем, он отдаёт два электрона и переходит в ион SО4(S).
В молекуле КМnO4 ион МnO4(Мn) является окислителем, в сильно концентрированной щелочной среде и недостатке восстановителя он принимает один электрон и восстанавливается.
Ставим под восстановителем число 2, а под окислителем 1. Затем находим коэффициенты для восстановителя и окислителя.
Для этого число 2, находящееся под восстановителем, ставим перед окислителем, а число 1, находящееся под окислителем, ставим перед восстановителем.
Следовательно, на одну молекулу Na2SO3 требуется две молекулы КМnO4.
Таким образом, уравнение принимает следующий вид:
3) Находим коэффициент для щёлочи. Для этого подсчитываем в правой и левой частях уравнения число ионов металла, не изменивших своей валентности, и по разности находим коэффициент.
В правой части уравнения имеется 4К•, а в левой 2К• по разности (4 — 2 = 2) находим коэффициент для щёлочи:
4) Проверяем водород и находим число молекул образовавшейся воды. В данном случае получается одна молекула.
Приводим ещё уравнения реакций окисления-восстановления в сильно щелочной среде:
Реакции в нейтральной среде
Ниже приводим готовые уравнения окислительно-восстановительных реакций с участием воды:
Кроме среды, важными факторами, влияющими на направление и скорость окислительно-восстановительных процессов, являются также концентрация, температура и катализатор.
Можно предвидеть смещение равновесия окислительно-восстановительной реакции в зависимости от концентрации реагирующих веществ.
Так, например, при увеличении концентрации окислителя или восстановителя равновесие будет смещаться слева направо.
При увеличении же восстановленной или окисленной формы вещества равновесие будет смещаться в обратную сторону, т. е. справа налево.
С повышением температуры течение окислительно-восстановительных реакций обычно ускоряется.
Однако если температура в одинаковой степени ускоряет обе реакции прямого и обратного процесса, то изменения в состоянии равновесия не происходит.
Влияние температуры значительно сказывается в случае, когда наблюдается различное ускорение прямого и обратного процессов от температуры.
Так, например, повышение температуры ускоряет реакцию между щавелевокислым натрием и перманганатом калия в кислой среде, эта реакция идёт практически необратимо:
5Na2C2O4 + 2KMnO4 + 8H2SO4 → 5Na2SO4 + 10CO2 + 2MnSO4 + K2SO4 + 8H2O
Температура может не только изменить направление и скорость окислительно-восстановительной реакции, но и её характер.
Например, КМnO4 при достаточно высокой температуре распадается по уравнению:
2КМnO4 → К2MnO4 + MnO2 + O2
При слишком высокой температуре в реакциях окисления-восстановления КМnO4 будет расходоваться не только на окисление восстановителя (в зависимости от среды), но и по указанной реакции на разложение.
В данном случае, помимо основной реакции, будет протекать ряд побочных процессов.
На скорость окислительно-восстановительных реакций, кроме указанных факторов, влияет также катализатор.
Наиболее известны положительные катализаторы, т. е. ускоряющие течение реакций. Менее известны отрицательные катализаторы, замедляющие химические процессы.
Рассмотрим некоторые окислительно-восстановительные процессы, протекающие в присутствии катализатора.
Окисление щавелевой кислоты перманганатом калия значительно ускоряется в присутствии ионов Мn•• как катализатора. Образующиеся при этой реакции ионы Мn•• затем сами являются катализатором.
Химический процесс, в котором роль катализатора выполняет одно из исходных или образующихся в результате реакции веществ, называется автокатализом.
В лабораторных условиях кислород обычно получают из бертолетовой соли, которая в присутствии МnO2 как катализатора значительно быстрее разлагается.
Наблюдается также ускорение разложения КМnO4 в присутствии МnO2.
В качестве примера отрицательного катализатора может служить глицерин в растворе сульфита Na2SO3, замедляющий окисление Na2SO3 в Na2SO4 кислородом воздуха.
Другим примером отрицательного катализатора являются следы кислорода, замедляющие взаимодействие хлора с водородом под действием света.
В тех случаях, когда одна окислительно-восстановительная реакция ускоряет другую, говорят о сопряжённых, или индуцированных, реакциях (Н. А. Шилов, 1904 г.).
Многие окислительно-восстановительные реакции являются сопряжёнными.
Например, медленно протекающая реакция окисления хлор-иона перманганатом:
5Cl‘ + MnO‘4 + 8H• → 5Cl + Mn•• + 4H2O
ускоряется одновременно идущей реакцией окисления двухвалентного железа перманганатом:
5Fe•• + MnO‘4 + 8H• → 5Fe••• + Mn•• + 4H2O
Особые случаи составления уравнений окислительно-восстановительных реакций
Рассмотренная выше методика составления уравнений окислительно-восстановительных реакций применима к огромному большинству простейших и сложных процессов.
Однако при составлении уравнений окислительно-восстановительных реакций следует иметь в виду следующие особые случаи:
1-й Случай. Если в реакции число электронов, теряемых восстановителем, и число электронов, принимаемых окислителем, являются чётными числами, то при нахождении коэффициентов число электронов делят на общий наибольший делитель.
Если же число электронов, теряемых восстановителем и приобретаемых окислителем, нечётно, а в результате реакции должно получиться чётное число атомов, то коэффициенты удваиваются.
2-й Случай. Иногда восстановитель или окислитель расходуется дополнительно на связывание образующихся в результате реакции продуктов.
В этой реакции десять молекул НВr реагируют как восстановители, а шесть молекул НВr необходимы для связывания получающихся веществ.
3-й Случай. В реакции восстановителем являются: в одной молекуле одновременно положительно и отрицательно заряженные ионы, а в другой — окислителем многовалентные ионы.
4-й Случай. Восстановителем и окислителем являются ионы одного и того же элемента, но входящие в состав различных веществ.
Примером данного типа может служить реакция йодистого калия с йодноватокислым калием, протекающая в кислой среде.
При написании химических уравнений следует иметь в виду, что они нередко отображают только исходные и конечные превращения, хотя на самом деле реакции часто протекают более сложно и в несколько стадий.
Так, например, реакцию окисления железа с избытком разбавленной азотной кислоты выражают суммарным уравнением:
Fe + 4HNО3 = Fe(NО3)3 + NO + 2H2О.
На самом деле реакция протекает в две стадии:
1) образование азотнокислого железа (закисного) Fe(NО3)2 при взаимодействии железа с азотной кислотой:
3Fе + 8HNO3 = 3Fe (NO3)2 + 2NO + 4Н2O;
2) окисление Fe(NO3)2 избытком HNO3:
3Fe(NO3)2 + 4HNO3 = 3Fe(NO3)3 + NO + 2H2O.
Статья на тему Реакции окисления восстановления

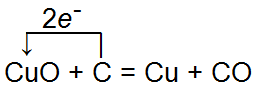
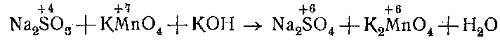
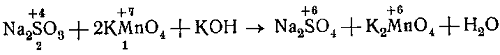
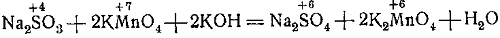
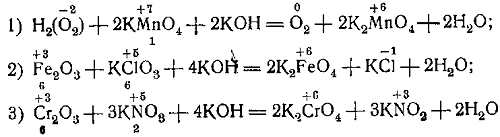
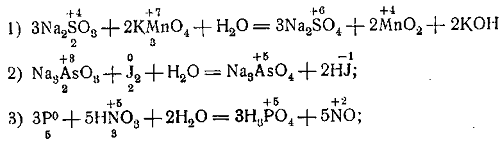
Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.