Тантал это металл номер 73, химический элемент, простое вещество, назван в честь мифологического персонажа Тантала.
По своим свойствам очень похож на ниобий, поэтому его часто путали с ним.
Получают восстановившим пятиокись тантала Та2О5 углеродом в электрической печи.
Применяют в радиоэлектронике, в сплавах, металлургии и т.д.
Сколько стоит тантал — это зависит спросов рынка, стоимости волют и т.д., на данный момент стоимость его в пределах 400 — 500 долларов за килограмм.

Что такое тантал
(Tantalum; по имени мифологического фригийского царя Тантала), Та — химический элемент пятой (5) группы (устаревшей побочной подгруппы V) периодической системы элементов.
Атомный номер 73, атомная масса 180,9479.
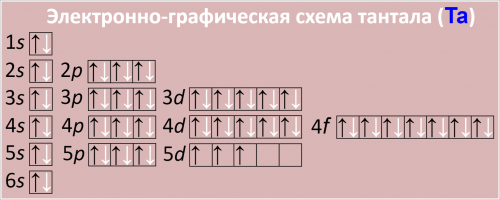
Электронная конфигурация [Xe]:
6s24f145d3.
Полная электронная конфигурация атома тантала:
1s22s22p63s23p64s23d104p65s24d105p66s24f145d3.
Пластичный металл серо-стального цвета с синеватым оттенком.
Наиболее типична для тантала степень окисления + 5; известны также соединения со степенями окисления — 1, + 1, + 2, + 3 и + 4.
История
Тантал впервые обнаружил (1802) швед, химик А. Г. Экеберг в минералах Скандинавского полуострова.
Вследствие близости физико-хим. св-в тантал и ниобий всегда сопутствуют друг другу, и их долго считали идентичными.
В чистом виде тантал получил (1903) нем. химик В. фон Болтон. Промышленное производство началось в 1922 (США).
Тантал мифология
По преданиям в греческой мифологии Тантал раскрыл тайны богов, за что и был покаран Зевсом. Тантал это сын верховного греческого бога Зевса.
По версиям он рассказал замыслы богов людям, по второй похитил амброзию чтобы отведать со своими друзьями и третья версия он дал ложную клятву, что он не был участником кражи золотой собаки.
За свои злодеяния Тантал был изгнан во владения Аида, также существует множество аналогичных версий.
Физические свойства тантала
Плотность 16,65 г/см3; tпл 2996° С; tкип 5309 С; температурный коэфф. линейного расширения (град ): 6,55 х 10-6 (т-ра 0-100° С); 6,6 х 10-6 (т-ра 0-500° С) и 8,0 х 10-6 (т-ра 20-1500° С); коэфф. теплопроводности (при комнатной т-ре) 0,130 кал/см х сек х град.
Удельная теплоемкость (кал/г-град): 0,03322 (т-ра 0° С); 0,03364 (т-ра 100° С); 0,03495 (т-ра 400° С); 0,03679 (т-ра 800° С); 0,03873 (т-ра 1200° С); 0,04078 (т-ра 1600° С) и 0,044 (т-ра 2000° С).
Удельное электрическое сопротивление (мком х см), 12,4 (т-ра 18° С); 54 (т-ра 1000° С); 71 (т-ра 1500° С) и 87 (т-ра 2000° С).
Скрытая теплота плавления 6,9 ккал/моль; теплота испарения составляет 180 ккал/г-атом.
Твердость 90—150 кгс/мм2 при чистоте 99,95—99,9%; твердость после электроннолучевой или зонной плавки 70—90 кгс/мм2, при т-ре 1200° С она составляет 20 кгс/мм2.
Предел прочности тантала высокой чистоты 19—23 кгс/мм2; предел текучести 18,4 кгс/мм2; относительное удлинение 36—38%; относительное сужение поперечного сечения около 90%.
В зависимости от содержания примесей предел прочности достигает 126 кгс/мм2. С повышением т-ры предел прочности снижается до 5кгс/мм2 при т-ре 1550° С и до 3,6 кгс/мм2 при т-ре 1980° С.
Модуль упругости 19 000 кгс/мм2; модуль сдвига 7000 кгс/мм2; коэфф. сжимаемости 0,52-10 6 см2/кгс.
Переход из пластичного состояния в хрупкое не обнаружен вплоть до т-ры — 250 ° С .
Температура рекристаллизации 1050 — 1500° С в зависимости от чистоты и степени деформации.
Ионизационный потенциал 7,3 ± 0,3 эв. Работа выхода электронов 4,1 эв. эна Т-ра перехода в сверхпроводящее состояние 4,38 К.
Сечение захвата тепловых нейтронов 21,3 барн/атом.
Химические свойства тантала
По своим химические свойства металлический тантал стоек в большинстве агрессивных сред, в том числе в «царской водке». Взаимодействует с плавиковой к-той, с расплавами щелочей, с серной и ортофосфорной к-тами выше т-ры 50—100° С.
Стойкость металлического тантала обусловлена наличием на поверхности тонкой прочной пленки пятиокиси Та2О5.
Способностью разрушать такую пленку обладают ионы фтора, серный ангидрид и расплавы щелочей. Тантал в значительных количествах абсорбирует водород, кислород и азот.
Стоек на холоду в среде воздуха. При нагревании выше т-ры 300° С начинает окисляться, на поверхности образуется пористый слой пятиокиси тантала с амфотерными св-вами, преим. кислотными.
С основаниями пяти-окись образует соли, к-рые являются производными гипотетической танталовой к-ты,— танталаты.
Тантал взаимодействует с фтором при комнатной т-ре, с хлором — выше т-ры 250° С, с бромом — выше т-ры 300° С, с йодом не взаимодействует вплоть до т-ры красного каления.
Углерод и углеродсодержащие газы при т-ре 1200—1400° С взаимодействуют с танталом с образованием карбидов.
При т-ре ~ 500° С образуются гидриды. Тантал не взаимодействует с газообразным хлористым водородом до т-ры 400° С, а с бромистым водородом — до т-ры 375° С.
Образует интерметаллические соединения преим. с переходными металлами VII—VIII и металлами Hie — IVe подгрупп периодической системы элементов.
Тантал стоек к действию некоторых расплавленных металлов, например висмута — до т-ры 980° С, свинца — до т-ры 1000° С.
Находится в одной группе с другими элементами, но валентность тантала является ключевым свойством, отличающим его от многих других элементов.
Причина таких валентностей кроется в его атомарном строении. Чтобы увидеть это наглядно, обратите внимание на электронную формулу атома тантала.
Изотопы
Природный тантал состоит из стабильного изотопа 181Та и радиоактивного изотопа 180Та с периодом полураспада 1012 лет.
Получены 15 радиоактивных изотопов.
Минералы

Содержание Тантал в земной коре 2 < 10-4 %. Т. в природе встречается совместно с ниобием в виде изоморфных танталитов и ниобатов.
Известно более 100 минералов, содержащих тантал. Основные из них: колумбит-танталит, микролит, лопарит, некоторые титановые минералы (например, ильменорутил).
Большинство танталовых руд содержит значительное количество ниобия. Кристаллическая решетка тантала объемноцентрированная кубическая с периодом а — 3,3025 А.
Получение
Переработка рудного сырья на металлический тантал включает получение концентратов, содержащих до 40— 65% Та2О5.
Тантал определяют с помощью химического анализа на тантал.
Гравитационным обогащением с последующей электромагнитной или электростатической сепарацией, флотацией или с применением комплексных магнитно-химических методов.
Вскрытие концентратов (сплавлением со щелочами или разложением к-тами, в частности плавиковой).
В результате к-рого получают тантал и сопутствующий ему ниобий в виде окислов, хлоридов или фтористых компл. солей.
Разделение соединений тантала и ниобия (жидкостной экстракцией органическими реагентами, дробной кристаллизацией комплексных фтористых соединений, ректификацией хлоридов.
А также разделением с помощью ионообменных смол; получение металлического тантала из его соединений (электролизом расплавленных фтористых сред; восстановлением натрием из комплексных фтористых солей, в частности из K2TaF7; восстановлением галогенидов магниевой стружкой или натрием; термической диссоциацией галогенидов).
Обычно тантал получают в виде танталового порошка чистотой 98—99%.
Чтобы получить металл в компактном виде, прибегают к спеканию предварительно спрессованных заготовок прямым пропусканием тока при т-ре 2500— 2700° С.
Или косвенным нагреванием при т-ре 2200—2500° С в вакууме; при этом чистота металла повышается до 99,9—99,95%.
Для получения больших слитков и для рафинирования применяют электровакуумную плавку в дуговых печах с расходуемым электродом и в электроннолучевых печах.
В процессе вакуумного переплава общее содержание кислорода, азота и углерода снижается от 0,1—0,5 до 0,01—0,05%.
Для произ-ва стержней высокой чистоты и изготовления монокристаллов прибегают к зонной плавке.
Тантал подвергают обработке давлением на холоду (ковке, прокатке, штампованию, экструзии, волочению), получая прутки, проволоку, листы, трубы и фасонные изделия.
Чтобы снять напряжения, в процессе деформирования изделий осуществляют промежуточный отжиг в высоком вакууме или в среде очищенного инертного газа при т-ре 1200—1650° С .
Применение
Тантал обладает хорошей свариваемостью, в связи с чем применяют различные виды дуговой сварки в аргоне или гелии, перспективна сварка электронным пучком.
Возможна пайка спец. припоями с соблюдением мер предосторожности.
Танталом можно покрывать нержавеющими сталями и тугоплавкими металлами и сплавами, обрабатывать резанием (при наличии смазки).
Области применения определяются благоприятным сочетанием высокой температуры плавления, пластичности, прочности, свариваемости, коррозионной стойкости, теплопроводности, способности поглощать газы и низкой упругости пара.
Основное количество тантала (60— 75%) используют в электровакуумной технике: он служит материалом для геттеров, анодов, сеток и др. и деталей электронных ламп.
В электротехнической промышленности тантал применяют для изготовления нагревателей элементов конструкций (экранов, контактов и др.) печей.
Эксплуатируемых при т-ре выше 1700° С в вакууме или среде инертного газа; для изготовления электролитических конденсаторов, выпрямителей.
Около 20—30% металла используют в произ-ве деталей химической аппаратуры. Тантал — заменитель платины в произ-ве лабораторной посуды, аналитических разновесов.
Из него изготовляют прядильные фильеры, служащие для получения нитей искусственного шелка.
Тантал используют в качестве легирующей добавки при произ-ве высокопрочных, коррозионностойких и жаропрочных сталей и спец. сплавов.
Соединения тантала (например, фтористые комплексные соли) применяют в качестве катализаторов, пятиокись тантала используют в произ-ве стекол и керамики со спец. свойствами. См. также Тантала сплавы.
Свойства простых веществ и соединений
По своему свободному состоянию и по химическим взаимодействиям члены подгруппы VB — тантал — резко отличаются от сурьмы и висмута.
Металл — тантал — очень тугоплавок, тверд, химически малоактивен. Кристаллизуются в кубической объемноцентрированной решетке.
Химическая активность примерно одинакова с ниобием. Ни вода, ни большинство кислот на него не действуют.
На воздухе он покрыт плотным слоем оксидов, который препятствует при обычной температуре их дальнейшему взаимодействию даже с такими активными химическими реагентами, как кислород, галогены и сера.
Только довольно значительное нагревание способно вывести его из столь пассивного состояния.
На тантал даже «царская водка» — смесь, способная растворять золото, не действует.
Он может раствориться только в еще более грозной смеси плавиковой и азотной кислот. Взаимодействие с водородом идет довольно легко, однако при поглощении водорода этим металлам определенных соединений не образуется.
Состав максимально насыщенных водородом продуктов приближается к формуле ЭН, т. е. на каждый атом металла приходится один атом водорода.
Если рассматривать свойства металлов в состоянии со степенью окисления +5, нужно отметить следующее: оксиды — плотные, устойчивые, инертные вещества.
По размерам атома и иона тантал и ниобия близки друг к другу.
Это отражается и на свойствах оксидов, температура образования которых у ниобия и тантала высокая, как и температура плавления оксидов, а высшие оксиды Nb2O5 и Та2O5 практически нерастворимы в воде.
Кислотные свойства гидроксидов выше, чем в подгруппе титана, и падают от ванадия к танталу. Гидроксид ванадия— слабая кислота, а тантала — соединения амфотерные.
Так как у этого элемента не заполнены d -орбитали, то значит он способен образовывать комплексные соединения. Взаимодействуя со смесью азотной и плавиковой кислот, он даёт комплексы типа H(TaF6] .
Получение и использование
Тантал получают из полиметаллических руд, содержащих железо, титан, цирконий и др. Его превращают в пентоксиды Та2O5 или пентагалогениды.
А затем восстанавливают до металла водородом, кальцием или алюминотермическим способом получают ферротантал.
Тантал обладают ценным сочетанием качеств. Химическая инертность позволяет его использовать в высоко агрессивных средах, вплоть до атомных реакторов, а так же в костной и пластической хирургии.
Он нисколько не вредит деятельности живых тканей организма. Тонкие пластинки и проволока из тантала — ценнейший медицинский материал.
Танталовые заплаты черепа, скрепление костей и даже сшивание нервов стали возможны благодаря такому удивительному свойству этого металла.
Смесь Ta2O5 с Fe2О3 предложено использовать для ускорения свертываемости крови.
Применение тантала позволило резко расширить ассортимент сталей и сплавов. Самые твердые сплавы делают из карбида тантала с добавкой никеля в качестве цементирующей добавки.
Эти сплавы настолько тверды, что оставляют царапины даже на алмазе, который считается эталоном твердости.
Литература
Самсонов Г. В.,Константин о в В. И. Тантал и ниобий. М., 1959; Горощенко Я. Г. Химия ниобия и тантала. К.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.