Щелочные металлы это металлы представляют собой группу или столбец, содержащий химические элементы, такие как литий (Li), натрий (Na), рубидий (Rb), калий (K), франций (Fr) и цезий (Cs).
Эта группа находится в s-блоке периодической таблицы, поскольку все щелочные металлы имеют свой периферийный электрон на s-орбитали/
Эта общая электронная конфигурация приводит к принципиально чрезвычайно схожим характеристическим особенностям.
Что такое щелочные металлы
Все щелочные металлы проявляют резко выраженные металлические свойства. Чистая поверхность металла обладает ярким серебристым блеском.
Металлы очень хорошо проводят электрический ток и тепло. Они мягкие, ковкие и имеют низкие температуры плавления (по сравнению почти со всеми другими металлами).
К этой группе относятся литий , натрий , калий , рубидий , цезий , франций . Щелочные металлы имеют на внешнем электронном уровне атома по одному электрону ( s¹ ) , сильно удалённому от ядра , отличаются низкими потенциалами ионизации.
Щелочные металлы, как правило, являются блестящими, мягкими и очень активными металлами при стандартной температуре и давлении и быстро теряют свой самый дальний электрон, образуя катионы с зарядом +1.
Все они могут быть эффективно разрезаны лезвием из-за их мягкой структуры, открывая блестящую поверхность, которая быстро обесцвечивается на воздухе из-за окисления атмосферной влажностью и кислородом (и за счет лития, азота).
Из-за их высокой реакционной способности их следует помещать под масло, чтобы избежать реакции с воздухом, и обычно они содержатся только в щелочах, а не в качестве свободных компонентов.
Цезий, пятый щелочной металл, является наиболее реакционно способным из значительного числа металлов.
В классификации IUPAC щелочные металлы включают элемент группы 1, за исключением водорода (H), который якобы является компонентом группы 1.
Однако регулярно не рассматривается как щелочной металл, поскольку он редко демонстрирует поведение, идентичное поведению щелочных металлов.
Все щелочные металлы вступают в реакцию с водой, причем более тяжелые щелочные металлы реагируют более интенсивно, чем более легкие.
Щелочные металлы это элементы с высокой электропроводностью. Поэтому они так хорошо проводят электрический ток.
Это происходит потому, что в кристаллической решетке металлов всегда имеется некоторое количество чрезвычайно подвижных электронов.
Эти «электроны проводимости» двигаются по всему кристаллу металла, не принадлежа ни одному из атомов в отдельности.
Щелочные металлы обладают резко выраженными металлическими свойствами, так как они легко отдают по одному электрону на атом, что обеспечивает запас «электронов проводимости».
Легкость отдачи этих электронов проводимости обусловлена устойчивостью электронных конфигураций, которые приобретают атомы после отдачи одного электрона.
Шесть элементов, непосредственно следующие за инертными газами,— литий, натрий, калий, рубидий, цезий и франций.
Эти элементы, обладающие сходными химическими свойствами, называются щелочными металлами. На рис. показано, что эти элементы являются соседями инертных газов.
Химию щелочных металлов можно понять, если исходить из представления об особой устойчивости ионов с зарядом 1+, имеющих электронную конфигурацию инертных газов.
Спектр преломления
Большинство щелочных металлов имеют широкий спектр применения. Одним из наиболее известных применений чистых компонентов является использование рубидия и цезия в ядерных таймерах, из которых ядерные тикеры цезия являются наиболее точным и точным отображением времени.
Типичным использованием соединений натрия является натриевая лампа, которая излучает свет со всей эффективностью. Поваренная соль, или хлорид натрия, использовалась с давних времен.
Натрий и калий также являются основными компонентами, выполняющими основную естественную работу в качестве электролитов, и, несмотря на то, что другие щелочные металлы не являются основными, они также влияют на организм, как полезные, так и вредные.
Атомы их легко отдают электрон , проявляя степень окисления + 1 . Это самые активные металлы , восстановительные свойства выражены у них особенно резко и усиливается с увеличением порядкового номера элемента .
Унуненний Ununennium
Испытания были направлены на то, чтобы попытаться объединить Ununennium (Использование), который, вероятно, станет следующим человеком из группы, однако все они потерпели неудачу.
В любом случае, Ununennium может не быть щелочным металлом из-за релятивистских воздействий, которые, как ожидается, повлияют на свойства соединений сверхтяжелых компонентов.
Независимо от того, окажется ли он щелочным металлом, ожидается, что он будет иметь несколько отличий в физических и синтетических свойствах от его более легких гомологов.
Физические свойства щелочных металлов
Щелочные металлы мягки , легко режутся ножом , на свежем срезе имеют серебристую окраску ( кроме цезия ).
Все они лёгкие и легкоплавкие металлы с хорошей электропроводностью. Физические свойства щелочных металлов в целом изменяются линейно при переходе от лития к цезию , т.е с увеличением массы и радиуса атома.
Физические и химические свойства щелочных металлов можно быстро уточнить, установив для них валентные электроны ns1, что приводит к хрупкому удерживанию металла.
Отныне все щелочные металлы являются мягкими и имеют низкую плотность, точки плавления и пузырькования, а также температуры сублимации, испарения и диссоциации.
Все они затвердевают в кубической структуре драгоценного камня, ориентированной на тело, и имеют особые огненные оттенки на том основании, что их внешний электрон всесторонне эффективно возбуждается.
Установка ns1 также приводит к тому, что щелочные металлы имеют огромные ядерные и ионные радиусы, а также высокую теплопроводность и электропроводность.
Физические свойства франция
Ожидается, что франций также продемонстрирует несколько контрастов из-за своего высокого ядерного веса, что позволит его электронам перемещаться со значительной скоростью света и, следовательно, сделает релятивистские воздействия все более заметными.
В отличие от модели уменьшения электроотрицательности и энергий ионизации щелочных металлов, ожидается, что электроотрицательность и энергия ионизации франция будут выше, чем у цезия, из-за релятивистской регулировки электронов 7s ; аналогичным образом, считается, что его ядерный размах странно низок.
Следовательно, вопреки ожиданиям, цезий является наиболее восприимчивым из щелочных металлов, а не франций.
Ожидается, что франций также продемонстрирует несколько контрастов из-за своего высокого ядерного веса, что позволит его электронам перемещаться со значительной скоростью света и, следовательно, сделает релятивистские воздействия все более заметными.
В отличие от модели уменьшения электроотрицательности и энергий ионизации щелочных металлов, ожидается, что электроотрицательность и энергия ионизации франция будут выше, чем у цезия, из-за релятивистской регулировки электронов 7s ; аналогичным образом.
Считается, что его ядерный размах странно низок. Следовательно, вопреки ожиданиям, цезий является наиболее восприимчивым из щелочных металлов, а не франций.
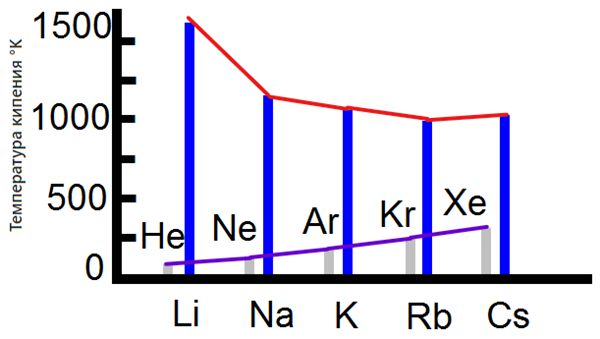
Температура плавления и температура кипения
Все щелочные металлы при комнатной температуре находятся в твердом состоянии, хотя температура плавления цезия лишь немного выше комнатной, температура плавления.
Так и температура кипения уменьшаются с увеличением порядкового номера (в противоположность поведению инертных газов).
На рис. приведены температуры плавления, температуры кипения и атомный объем щелочных металлов как функции порядкового номера.
Здесь же приведены изменения соответствующих величин для инертных газов, что позволяет легко сопоставить свойства.
Таблица свойств щелочных металлов
| Свойство | Литий | Натрий | Калий | Рубидий | Цезий |
| Порядковый номер | 3 | 11 | 19 | 37 | 55 |
| Атомный вес | 6.94 | 23.0 | 39.1 | 85.4 | 133 |
| Температура кипения °К | 1599 | 1162 | 1030 | 952 | 963 |
| Температура кипения °С | 1326 | 889 | 757 | 679 | 690 |
| Температура плавления °К | 453 | 371 | 336,4 | 311,8 | 301,7 |
| Температура плавления °С | 180 | 98 | 63,4 | 38.8 | 28,7 |
| Атомный объем в твердом состоянии, см3/моль атомов | 13,0 | 23,7 | 45,4 | 55,8 | 70.0 |
| Плотность в твердом состоянии при 20°С | 0,535 | 0,971 | 0,862 | 1.53 | 1.90 |
Следует отметить также, что в расплавленном состоянии щелочные металлы устойчивы в широком интервале температур.
Например, натрий плавится при 371° К и кипит при 1162° К, т. е. почти на 800° выше. Неон плавится при 24,6° К, а кипит только на 2,6° выше — при 27,2° К.
Вот насколько различны температуры плавления и температуры кипения щелочного металла и инертного газа, хотя их порядковые номера отличаются всего на единицу.
Плотность щелочных металлов
Все щелочные металлы имеют одинаковую структуру (кубическую по центру тела), и в соответствии с этими линиями плотность-это масса общего числа атомов, которые могут поместиться в определенном объеме.
Основной фактор зависит от объема молекулы и следовательно, ядерного диапазона, который увеличивается по группе; вдоль этих линий объем атома щелочного металла увеличивается по группе.
Масса атома щелочного металла также возрастает, снижаясь по группе. Таким образом, структура плотности щелочных металлов зависит от их ядерных нагрузок и радиусов ядер.
Если бы были известны значения этих двух факторов, то можно было бы определить пропорции между плотностями щелочных металлов.
Ядерные свойства щелочных металлов
Все щелочные металлы имеют нечетные ядерные числа; таким образом, их изотопы должны быть либо нечетно– нечетными (числа протонов и нейтронов нечетные), либо нечетно-четными (число протонов нечетное, однако число нейтронов четное).
Нечетные– нечетные ядра имеют четные массовые числа, в то время как нечетные-четные ядра имеют нечетные массовые числа.
Нечетные– нечетные первичные нуклиды редки в свете того факта, что большинство нечетных ядер чрезвычайно нестабильны при бета– распаде, на том основании, что элементы распада четные-четные, и, следовательно, все более четко связаны из-за воздействия атомного смешения.
Атомный и ионный радиусы
Ядерные радиусы щелочных металлов повышаются, снижаясь по группе. Из-за защитного воздействия, когда частица имеет более одной электронной оболочки, каждый электрон испытывает электрическое отвращение от альтернативных электронов так же, как электрическое притяжение от ядра.
В щелочных металлах периферийный электрон просто ощущает чистый заряд +1, поскольку часть атомного заряда (что эквивалентно атомному номеру) отбрасывается внутренними электронами; количество внутренних электронов щелочного металла постоянно на единицу меньше, чем атомный заряд.
Таким образом, первым фактором, влияющим на ядерный диапазон щелочных металлов, является количество электронных оболочек.
Поскольку это число увеличивается в группе, ядерный радиус действия также должен уменьшаться в группе.
| Щелочной металл | Структура электронов | Всего электронов |
| литий (Li) | 2,1 | 3 |
| натрий (Na) | 2,8,1 | 11 |
| калий (К) | 2,8,8,1 | 19 |
| рубидий (Rb) | 2,8,8,8,8,3 | 37 |
| цезий (Cs) | 2,8,8,8,8,8,8,5 | 55 |
| франция (Fr) | 2,8,8,8,8,8,8,8,8,8,8,5 | 87 |
Атомный объем щелочных металлов
Атомные объемы щелочных металлов, как и инертных газов, возрастают с увеличением порядкового номера.
Отметим, однако, что объем, занимаемый атомом щелочного металла, больше объема атома соседнего инертного газа (за исключением лития и гелия; гелий — причина этой аномалии).
Атом натрия в твердом металле занимает на 30% больший объем, чем атом неона. Объем, занимаемый атомом цезия, почти вдвое превышает объем атома ксенона.
Энергия первой ионизации
Первая энергия ионизации компонента или частицы — это энергия, необходимая для перемещения наиболее свободно удерживаемого электрона от одного моля парообразных атомов компонента или атомов, чтобы сформировать один моль парообразных частиц с электрическим зарядом +1.
Факторами, влияющими на первичную энергию ионизации, являются атомный заряд, мера защиты внутренними электронами и отделение от наиболее свободно удерживаемого электрона от ядра, которое, несомненно, является внешним электроном в компонентах фундаментальной группы.
Исходные два компонента изменяют жизнеспособный атомный заряд, который ощущает наиболее свободно удерживаемый электрон.
Поскольку периферийный электрон щелочных металлов надежно ощущает эквивалентный вынуждающий атомный заряд (+1), первым фактором, влияющим на основную энергию ионизации, является отделение от самого дальнего электрона до ядра.
Поскольку это разделение поднимается по группе, самый дальний электрон чувствует меньшее притяжение к ядру, и по этим линиям энергия первичной ионизации уменьшается.
Реакционная способность щелочных металлов
Реакционная способность щелочных металлов повышается по мере снижения группы. Это является следствием сочетания двух факторов: первой энергии ионизации и энергии распыления щелочных металлов.
Поскольку первая энергия ионизации щелочных металлов уменьшается по сравнению с группой, менее требовательно, чтобы периферийный электрон удалялся из атома и участвовал в химических реакциях, следовательно, реакционная способность группы повышалась.
Электроотрицательность
Электроотрицательность это химическое свойство, которое отражает тенденцию атома притягивать электроны (или электронную толщину) к себе.
Если бы связь между натрием и хлором в хлориде натрия была ковалентной, пара общих электронов была бы втянута в хлор на том основании, что жизнеспособный атомный заряд внешних электронов составляет +7 в хлоре, но составляет всего +1 в натрии.
Точки плавления и кипения
Температура плавления вещества это когда оно меняет свое состояние с твердого на жидкое, в то время как температура кипения вещества (в жидком состоянии) — это когда давление пара жидкости равно атмосферному давлению, охватывающему жидкость, и вся жидкость меняет состояние на газ.
Когда металл нагревается до температуры плавления, металлические связи, удерживающие атомы, ослабевают, чтобы молекулы могли перемещаться, и металлические связи в долгосрочной перспективе полностью разрушаются при температуре кипения металла.
Таким образом, падение, температура плавления и кипения щелочных металлов показывают, что качество металлических обязательств щелочных металлов снижается по группе.
Это объясняется тем, что частицы металла удерживаются вместе электромагнитной силой от положительных частиц к делокализованным электронам.
Взаимодействие щелочных металлов с водой
Взаимодействие щелочных металлов с водой. Натрий бурно реагирует с водой. В результате реакции образуются газообразный водород и водный раствор гидроокиси натрия (едкого натра) NaOH:
2Na (тв) + 2H2O → 2Na+ (водн) + 2OН— (водн) + Н2 (г) + Тепло (10)
При этой реакции выделяется тепло, и реакция часто протекает настолько быстро, что температура повышается и в результате бурного взаимодействия образующегося водорода с кислородом воздуха происходит взрыв.
Таким образом, металлический натрий довольно опасен и требует осторожного обращения. Описанное химическое свойство характерно для всех щелочных металлов.
Щелочные металлы проявляют сходство по отношению к воде. Кроме того, в продуктах реакции всегда присутствуют гидратированные ионы щелочного металла, у которого удален один электрон, т. е. ионы с зарядом 1+.
Химические свойства щелочных металлов
Их химия перегружена потерей их одиночного валентного электрона на периферийной s-орбитали для получения состояния окисления +1 из-за простоты ионизации этого электрона и высокой энергии второй ионизации.
Большая часть химии наблюдалась только у первых пяти человек из группы. Химия франция не изучена из-за его очень высокого уровня радиоактивности; соответственно, введение его свойств здесь ограничено.
То немногое, что думают о франции, свидетельствует о том, что она исключительно близка по проводимости к цезию, что неудивительно?
Физические свойства франция гораздо более схематичны в свете того факта, что массовая составляющая никогда не наблюдалась; впоследствии любая информация, которую можно найти в тексте, несомненно, является теоретической экстраполяцией.
Они весьма активны в химическом отношении . Восстановительная активность их быстро растёт при переходе от лития к францию вместе с увеличением ионизации потенциалов.
Кислород воздуха ( при обычной температуре ) окисляет по схеме :
4Э + O2 = 2Э2O
Поэтому хранят их под слоем жидких углеводородов ( керосина , бензола ) . Наиболее активные из них — рубидий и цезий — самовоспламеняются на воздухе , остальные загораются при небольшом нагревании .
Однако сгорании щелочных металлов только литий образует нормальный оксид Li2O , натрий образует пероксид Na2O2 , а калий , рубидий и цезий — супероксиды состава Э2O4 .
Другие элементарные окислители ( галогены , сера , фосфор ) также довольно легко окисляют щелочные металлы до галогенов , сульфидов , фосфатов ; все реакции протекают с выделением теплоты.
С азотом при обычной температуре взаимодействует только литий и получается нитрит Li3N . Нагревая щелочные металлы в струе газообразного водорода , получают гидриды :
2Э + H2 = 2ЭH
Причём атомы водорода восстанавливаются до отрицательно заряженных ионов Н⁻.
Имея большое отрицательное значение стандартных электродных потенциалов , щелочные металлы окисляются даже молекулами воды с образованием гидроксидов и выделением свободного водорода :
2Э + 2Н2О = 2ЭОН + Н2↑
Эти реакции экзотермичны , в следствие чего водород и металл обычно воспламеняются .
Химические свойства лития
Химия лития демонстрирует некоторые отличия от химии того, что осталось от группы. Литий и магний имеют диагональные отношения из-за их сопоставимых ядерных радиусов с целью продемонстрировать несколько сходств.
Например, литий образует устойчивый нитрид, свойство, обычное среди всех растворимых редкоземельных металлов (группа магния), однако исключительное среди щелочных металлов.
Кроме того, среди их конкретных групп только литий и магний структурируют металлоорганические соединения с критическим ковалентным характером (например, известь и MgMe2).
Фторид лития-первый галогенид щелочного металла, который неадекватно растворяется в воде, а гидроксид лития-первый гидроксид щелочного металла, который не растворяется.
И наоборот, перхлорат лития и другие щелочи лития с огромными анионами, которые не могут быть захвачены, значительно более устойчивы, чем соединения других щелочных металлов, предположительно в свете того факта, что Li+ обладает высокой энергией сольватации.
Это воздействие также подразумевает, что большинство простых литиевых щелочей обычно образуются в гидратированной структуре на том основании, что безводные структуры удивительно гигроскопичны.
Это позволяет использовать щелочи, такие как хлорид лития и бромид лития, в осушителях и системах принудительного воздуха.
Распространение в природе
Большинство всех обнаруженных щелочных металлов встречаются в природе в виде их соединений: по обилию наиболее часто встречается натрий, за ним следуют калий, литий, рубидий, цезий и, наконец, франций.
Что необычно из-за его невероятно высокой радиоактивности; франций встречается лишь в мельчайших следах в природе как промежуточное звено в некоторых отдельных частях цепей естественного распада.
Природный натрий и цезий — моноизотопные элементы , у лития и рубидия по два изотопа в природной смеси , а у калия — три , из которых один радиоактивный.
Щелочные металлы легко окисляются , поэтому в природе могут находится только в виде соединений , главным образом : хлоридов , сульфатов , карбонатов , нитратов , горных пород силикатного типа .
Наиболее распространены натрий и калий, содержание каждого из них в литосфере составляет приблизительно 2,6 масс.% , тогда на долю остальных щелочных металлов вместе взятых приходится около 0,014 масс.%.
Получение щелочных металлов
Щелочные металлы не восстанавливаются из природных соединений углём , оксидом углерода ( II ) и водородом.
Поэтому для получения их в свободном виде прибегают к электролизу расплавленных солей или гидроксидов.
Однако металлический калий получают не электролизом , а пропусканием через хлорид или гидроксид калия паров натрия при 800°C :
KCl + Na = K + NaCl
KOH + Na = K + NaOH
Рубидий и цезий восстанавливаются из хлоридов металлическим кальцием при 700 — 800°C , в вакууме :
Ca + 2RbCl = 2Rb + CaCl2
но цезий высокой чистоты получают в вакууме при 1000°C :
2CsCrO4 + 5Zr = 4Cs + 5ZrO + Cr2O3
Металлический литий восстанавливают из алюмината порошко-образным алюминием и так же в вакууме при 1200°C :
3(2Li2O · Al2O3) + 4Al = 12Li + 5Al2O3
Кроме того , литий получают электролизом расплавленного хлора.
Соединения щелочных металлов
Они образуют главным образом , соединения ионного типа . Их ионы Э на внешнем уровне имеют по 8 электронов ( кроме лития ) , не проявляют окислительных окислительных свойств в химической реакции , восстанавливаются только электролизом , не склонны к комплексообразованию ( кроме лития ) .
Гидриды щелочных металлов ЭН — солеобразные вещества , их ионы Н⁻ проявляют восстановительную активность в реакции с водой и другими оксидами :
ЭН + Н2О = H2↑+ ЭOH
Оксиды щелочных металлов ЭOH — твёрдые кристаллические вещества , сравнительно легкоплавки , хорошо растворяются в воде с выделением теплоты и почти полностью диссоциируют на ионы ; степень диссоциации их растёт от LiOH к CsOH .
Пероксиды ( перекиси ) типа Э2O2 известны для лития и натрия . Твёрдые , термически устойчивые вещества.
Рассматриваются как соли перекиси водорода , которая образуется при действии на них водой ( или кислотами ) :
Э2O2+ 2H2O =H2O2 + 2ЭOH
Супероксиды ( надперекиси ) типа Э2O4 известны для калия , рубидия и цезия. Под действием воды или кислот разлагаются с выделением перекиси водорода и кислорода :
Э2O4 + 2HOH = H2O2 + O2↑+ 2ЭOH
Пероксиды и супероксиды щелочных металлов — сильные окислители , активно иногда со взрывом взаимодействуют с порошкообразным металлом , углём и фосфором , применяются для изготовления запалов .
Соли щелочных металлов ( кроме лития ) хорошо растворимы в воде , летучие соли лития окрашивают бесцветное пламя горелки в коричнево — красный цвет , натрия — в жёлтый , калия — в фиолетовый , что используется в химическом анализе и в пиротехнике .
Соли щелочных металлов и слабых кислот ( угольной , сероводородной и других ) гидролизуются , водные растворы их имеют щелочную реакцию ( pH > 7 ) .
Кристаллическая решетка хлористого натрия
Кристаллическая решетка хлористого натрия построена из натрия Na+ и хлора Сl— Следовательно, при реакции (4) происходит перенос электронов от атомов натрия к атомам хлора.
Образовавшиеся ионы притягиваются друг к другу, так как они обладают разноименными зарядами. Разумеется, на отрыв электрона от атома натрия затрачивается определенная энергия.
Но эта энергия не очень велика, так как образующийся ион Na+ имеет электронную конфигурацию инертного газа неона.
Электрон, потерянный атомом натрия, присоединяется к атому хлора с образованием иона хлора Сl—. Эта реакция сопровождается выделением небольшого количества тепла, так как образовавшийся ион Сl— тоже обладает электронной конфигурацией инертного газа.
Затратив сравнительно небольшое количество энергии, можно оторвать электрон от атома натрия и передать его атому хлора с образованием ионов Na+ и Сl—.
Эти два иона могут сблизиться, при этом происходит значительное уменьшение общей энергии системы, т. е. выделяется большое количество тепла.
Можно сказать, что устойчивость кристалла хлористого натрия определяется электростатическим притяжением противоположно заряженных ионов. Кристалл образуется за счет ионных связей.
Такой тип взаимодействия характерен для всех щелочных металлов. Все они реагируют с хлором одинаково:
Li (тв) + 1/2 Сl2 (г) → LiСl (тв) + Тепло (5)
Na (тв) + 1/2 Сl2 (г) → NaСl (тв) + Тепло (6)
К (тв) + 1/2 Сl2 (г) → КСl (тв) + Тепло (7)
Rb (тв) + 1/2 Сl2 (г) → RbСl(тв) + Тепло (8)
Cs (тв) + 1/2 Сl2 (г) → CsСl (тв) + Тепло (9)
В каждом случае щелочной металл реагирует с образованием устойчивого ионного вещества, в котором металл присутствует в виде иона с электронной конфигурацией инертного газа.
Продукт реакции во всех случаях — кристаллическое твердое вещество, хорошо растворимое в воде.
Статья на тему Щелочные металлы




Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.