Теория:
Ртуть (Hg) занимает положение в 6‑м периоде, что определяет её уникальную природу как единственного металла, остающегося в жидком состоянии при нормальных условиях.
Будучи химическим гомологом (аналогом) цинка и кадмия, она завершает ряд переходных металлов своего периода.
Однако из-за сильных релятивистских эффектов её внешние электроны связаны очень прочно, что препятствует образованию кристаллической решетки при комнатной температуре.
А её нахождение в 12‑й группе (ранее — побочная подгруппа II группы) задает ключевые параметры:
Наиболее характерную валентность II.
А также способность образовывать уникальные связи металл-металл в катионах вида Hg22+.
Структура атома подтверждается её электронной формулой (конфигурацией):
[Xe] 4f14 5d10 6s2.
На которой наглядно можно определить её положение как d-блочного элемента, завершающего заполнение 5d-подуровня перед переходом к p-элементам (Таллию).
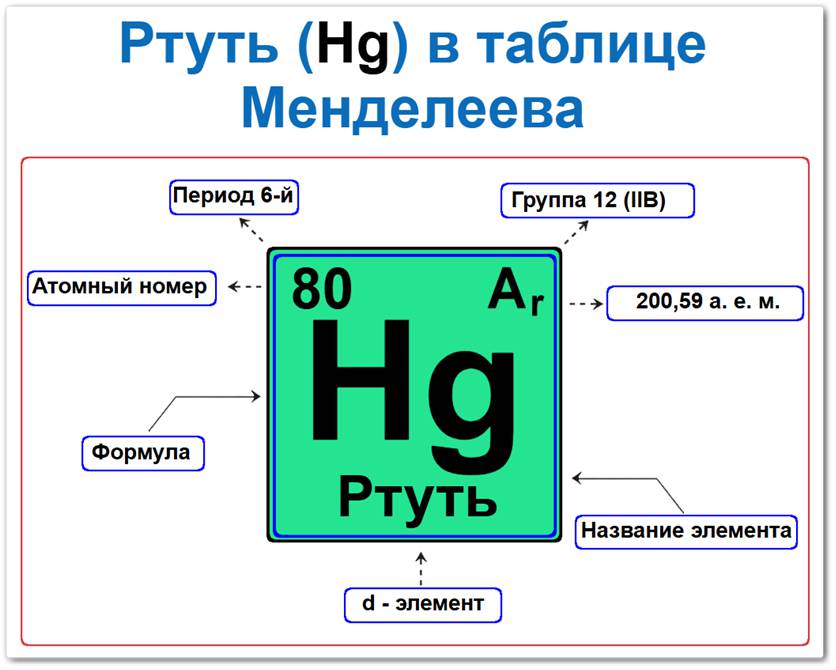
Ртуть в таблице Менделеева можно определить на основании закона периодичности: положение в группе и периоде, а также порядкового номера / атомный номер (Z = 80).
Как определить положение Ртути в Таблице Менделеева
Локация ртути в таблице описывается характеристиками её атомного ядра — её «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд, семейство цинка).
- Период (горизонтальный ряд).
- Электронное семейство (ртуть — d‑элемент).
Порядковый номер / атомный номер (Z = 80)
- Служит уникальным кодом элемента в системе.
- В ядре — 80 протонов; в нейтральной оболочке — 80 электронов.
- Электронное строение: [Xe] 4f14 5d10 6s2.
Важно: Полностью заполненные 5d и 6s оболочки делают ртуть химически инертной по сравнению с соседями, напоминая свойства благородных газов среди металлов.
Название и символ
- Название: «ртуть» (от праславянского «ruti» — катить, лить); латинское Hydrargyrum — «жидкое серебро».
- Символ: Hg.
- Примечание: Известна с глубокой древности, широко применялась алхимиками для амальгамирования золота.
Группа (12 / II B)
Расположена в 12‑й группе; по классической классификации — побочная подгруппа II группы (подгруппа цинка).
Химический потенциал:
- Валентность ртути: типичная валентность II, реже I.
- Степень окисления: +2 и +1. Оксид ртути (HgO) легко разлагается при нагревании, что позволило Пристли открыть кислород.
Период (6‑й)
Находится в 6‑м периоде — её электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Релятивистский эффект: Из-за огромного заряда ядра электроны 6s-орбитали движутся очень быстро и притягиваются сильнее. Это объясняет, почему ртуть не образует прочных связей с другими атомами ртути и остается жидкой.
- Диамагнетизм: Ртуть является диамагнетиком, что связано с полностью спаренными электронами на внешних уровнях.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Hg) ≈ 200,59 а.е.м.
- Определение: средневзвешенное значение массы семи стабильных изотопов, встречающихся в природе.
Все значения для всех элементов можно узнать в таблице атомных масс.
d‑Элемент (электронное семейство)
Застраивающимся является 5d‑подуровнь (5d10).
Специфика блока: Будучи d-элементом, ртуть завершает d-блок 6-го периода. Её электронная конфигурация крайне стабильна, что определяет её благородство (низкую реакционную способность).
Определение энергетических уровней Ртути по Таблице Менделеева
Положение Ртути (Hg) в системе Менделеева — это готовый «паспорт» её внутреннего устройства.
1. 6-й период (Количество этажей)
Ртуть находится в шестой строке таблицы. Номер периода определяет число электронных слоев.
- Итог: У Ртути 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Ртути — 80. Её 80 электронов распределены по уровням следующим образом:
Hg ) 2 ) 8 ) 18 ) 32 ) 18 ) 2
Для сравнения: У соседа слева, Золота (79), на внешнем уровне 1 электрон (провал электрона), а у Ртути (80) — устойчивая пара (2 электрона).
3. 12-я группа (Химический характер)
Ртуть завершает семейство цинка.
- d-элемент: Свойства диктуются завершенной d-оболочкой.
- Место в блоке: Является тяжелым аналогом кадмия (Cd), но отличается гораздо более высокой токсичностью и летучестью паров.
Проверка знаний: Как определить ртуть по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Ртуть (Hg) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 80. Главная координата Ртути.
- 2) 6-й период, 12-я группа. Указывает на принадлежность к тяжелым d-элементам.
- 3) Жидкий металл. Уникальное физическое свойство, обусловленное положением в таблице и релятивистскими эффектами.
- 4) Ошибка. Ртуть — d-элемент, а щелочноземельные — s-элементы.
- 5) Ошибка. Железо в 4-м периоде, ртуть значительно тяжелее.
- 6) Ошибка. Ртуть — тяжелая жидкость.
Часто задаваемые вопросы:
Ртуть расположена в 6-м периоде, 12-й группе (побочная подгруппа II группы). Атомный номер — 80.
У ртути 6 энергетических уровней, так как она находится в 6-м периоде.
Электронная схема: 2, 8, 18, 32, 18, 2.
Это связано с её положением в конце d-блока 6-го периода: электроны 6s-слоя из-за высокой скорости притяжения к ядру (релятивистский эффект) не участвуют в образовании металлической связи между атомами.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.