Hg ртуть (Hydrargyrum)- химический элемент шестого периода периодической системы химических элементов Д. И. Менделеева с порядковым номером 80 в периодической системе.
Атомный номер 80, атомная масса 200,59. Находится в шестом периоде. Температура плавления: -38.9 °C, температура кипения 356,73 °C. Плотность: 13.55 г/см3.
Электронная формула
Полная электронная формула атома ртути в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Сокращенная электронная конфигурация Hg:
[Xe] 4f14 5d10 6s2
Электронная формула атома ртути в порядке следования уровней:
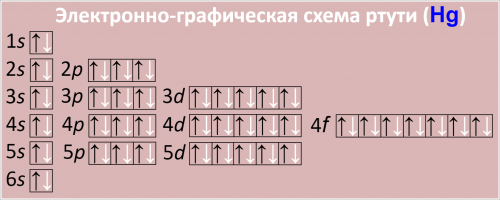
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 6s2
Электронно-графическая схема ртути (Hg)
Рис. Схема распределения электронов по атомным орбиталям в атоме ртути.
Энергетические уровни
Распределение электронов по орбиталям в атоме ртути:
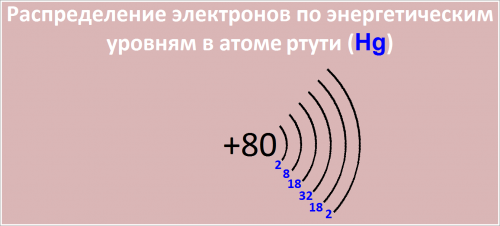
80 Hg )2 )8 )18 )32 )18 )2
Распределение электронов по энергетическим уровням в атоме Hg:
- -й уровень (K): 2
- -й уровень (L): 8
- -й уровень (M): 18
- -й уровень (N): 32
- -й уровень (O): 18
- -й уровень (P): 2
Рис. Распределение электронов по энергетическим уровням в атоме ртути.
Валентные электроны
Количество валентных электронов в атоме — 12.
Таблица квантовых чисел Hg (N — главное, L — орбитальное, M — магнитное, S — спин).
| Орбиталь | N | L | M | S |
| s | 6 | 0 | 0 | +1/2 |
| d | 5 | 2 | 0 | -1/2 |
| d | 5 | 2 | -2 | +1/2 |
| d | 5 | 2 | -1 | +1/2 |
| d | 5 | 2 | 0 | +1/2 |
| d | 5 | 2 | 1 | +1/2 |
| d | 5 | 2 | 2 | +1/2 |
| d | 5 | 2 | -2 | -1/2 |
| d | 5 | 2 | -1 | -1/2 |
| d | 5 | 2 | 0 | -1/2 |
| d | 5 | 2 | 1 | -1/2 |
| d | 5 | 2 | 2 | -1/2 |
В соединениях ртуть проявляет степень окисления: +1, +2, +4.
Находится в одной группе с другими элементами, но валентность ртути является ключевым свойством, отличающим его от многих других элементов.
Стабильные изотопы
| Изотоп | Протоны | Нейтроны | Атомная масса изотопа |
| 196Hg | 80 | 116 | ~195.965833 |
| 198Hg | 80 | 118 | ~197.966769 |
| 199Hg | 80 | 119 | ~198.9682799 |
| 200Hg | 80 | 120 | ~199.968326 |
| 201Hg | 80 | 121 | ~200.9703023 |
| 202Hg | 80 | 122 | ~201.970643 |
| 204Hg | 80 | 124 | ~203.9734939 |
Природная ртуть состоит из стабильных изотопов: 196Hg, 198Hg, 199Hg, 200Hg, 201Hg, 202Hg и 204Hg.
Получены 18 радиоактивных изотопов, из которых наибольшее практическое значение имеют изотопы 203Hg и 205Hg с периодами полураспада соответственно 47 дней и 5,1 мин.
Для более глубокого изучения его атомного строения, физических свойств и применения, мы рекомендуем ознакомиться с нашей главной статьей: ртуть химический элемент.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.