Теория:
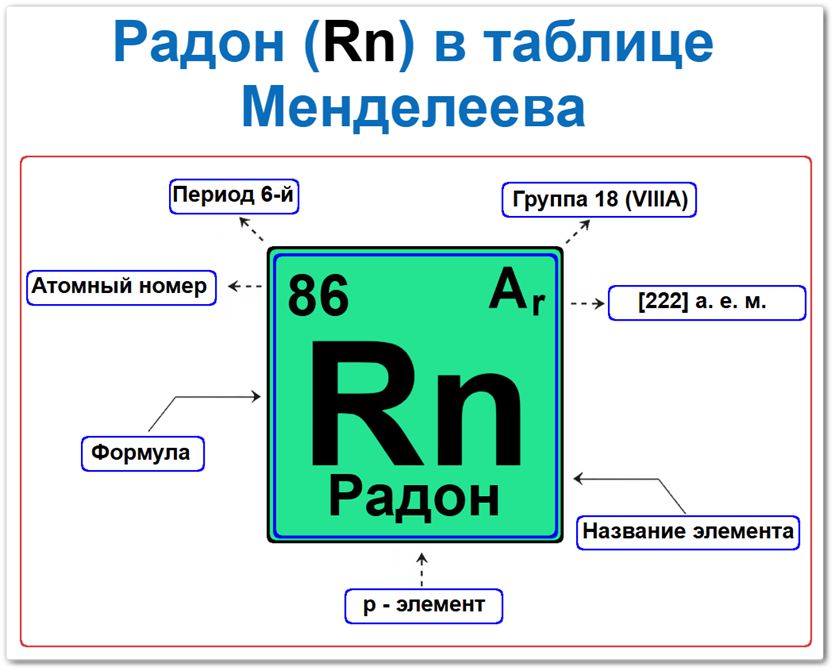
Радон (Rn) в периодической системе: 6‑й период, 18‑я группа (по устаревшей классификации — VIII A), атомная масса [222] а.е.м.
Занимает положение в 6‑м периоде, что определяет его статус самого тяжелого из природных благородных (инертных) газов.
Будучи химическим гомологом (аналогом) ксенона, он проявляет свойства типичного неметалла, находящегося в газообразном состоянии при нормальных условиях.
Его инертность продиктована полностью завершенной внешней электронной оболочкой.
А его нахождение в 18‑й группе (ранее — главная подгруппа VIII группы) задает ключевые параметры:
- Валентность 0 (в обычном состоянии).
- А также крайне ограниченную способность вступать в химические реакции, проявляя высшую степень окисления +2 или +6 только в жестких условиях с фтором.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Xe] 4f14 5d10 6s2 6p6.
На которой наглядно можно определить его положение как замыкающего элемента 6-го периода, находящегося после астата.
Радон в таблице Менделеева можно определить на основании закона периодичности: положение в группе и периоде, а также порядкового номера / атомный номер (Z = 86).
Как определить положение Радона в Таблице Менделеева
Локация радона в таблице описывается характеристиками его радиоактивного ядра и стабильной электронной оболочки — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд благородных газов).
- Период (горизонтальный ряд).
- Электронное семейство (радон — p‑элемент).
Порядковый номер / атомный номер (Z = 86)
- Служит уникальным кодом элемента в системе Менделеева.
- В ядре — 86 протонов; в нейтральной оболочке — 86 электронов.
- Электронное строение: [Xe] 4f14 5d10 6s2 6p6.
Важно: Наличие 6 электронов на 6p-подуровне создает устойчивый октет, что объясняет химическую пассивность радона.
Название и символ
- Название: «радон» (происходит от названия элемента радий, продуктом распада которого он является).
- Символ: Rn.
- Примечание: Радон — самый тяжелый газ; он в 7,5 раз тяжелее воздуха и может скапливаться в низинах и подвалах зданий.
Группа (18 / VIII A)
Расположен в 18‑й группе; по классической системе — главная подгруппа VIII группы.
Химический потенциал:
- Валентность радона: практически равна 0.
- Степень окисления: 0 (основная), +2 (в соединении RnF₂).
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Радиоактивность: Все изотопы радона радиоактивны. Самый стабильный — 222Rn (период полураспада 3,8 суток).
- Агрегатное состояние: Несмотря на большой атомный вес, остается газом из-за слабых межмолекулярных сил.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Rn) ≈ [222] а.е.м. (для наиболее часто встречающегося изотопа 222Rn).
- Определение: средняя масса нуклида в цепочке распада урана-238.
Все значения для всех элементов можно узнать в таблице атомных масс.
p‑Элемент (электронное семейство)
Застраивающимся является внешний p‑подуровнь (6p6).
Специфика блока: Радон завершает p-блок 6-го периода, что делает его химически самым стабильным в своем ряду.
Определение энергетических уровней Радона по Таблице Менделеева
Положение Радона (Rn) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Радон находится в шестой строке таблицы. Номер периода определяет число электронных слоев.
- Итог: У Радона 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Радона — 86. Его 86 электронов распределены по уровням следующим образом:
Rn ) 2 ) 8 ) 18 ) 32 ) 18 ) 8
Для сравнения: У соседа слева, Астата (85), на внешнем уровне 7 электронов, а у Радона (86) — 8 (завершенный уровень).
3. 18-я группа (Химический характер)
Радон является благородным газом.
- p-элемент: Его свойства диктуются полностью заполненной внешней p-оболочкой.
- Место в блоке: Он является «тяжелым аналогом» ксенона и криптона.
Проверка знаний: Как определить франций по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Радон (Rn) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 86. Точное место радона в периодическом ряду.
- 2) 18-я группа, 6-й период. Координаты самого тяжелого природного инертного газа.
- 3) p-элемент с октетом. Полная внешняя оболочка обуславливает его химическую пассивность.
- 4) Ошибка. Радон радиоактивен и очень тяжел; для шаров используют легкий и безопасный гелий.
- 5) Ошибка. Радон — это газ, неметалл.
- 6) Ошибка. Все изотопы радона радиоактивны и быстро распадаются.
Часто задаваемые вопросы:
Находится в 18-й группе (VIIIА подгруппа) и в 6-м периоде. Атомный номер — 86.
У него 6 энергетических уровней, так как он находится в 6-м периоде. Электронная схема: 2, 8, 18, 32, 18, 8.
Да, радон радиоактивен. Как газ, он может проникать в легкие, поэтому важна вентиляция подвальных помещений, где он может скапливаться.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.