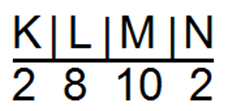Подгруппа цинка
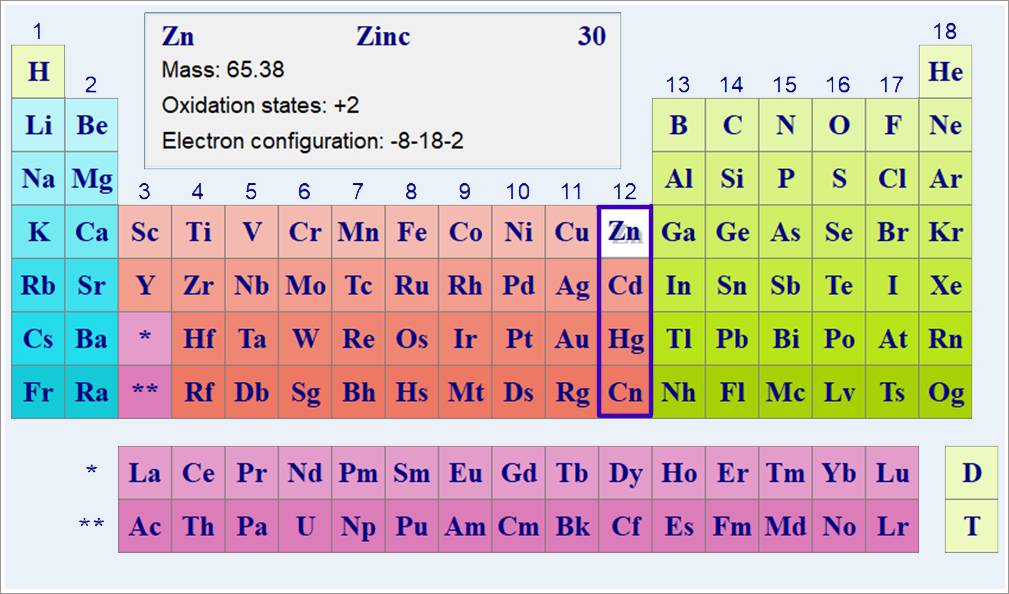
К элементам подгруппы цинка относятся металлы: цинк Zn, кадмий Cd, ртуть Hg и коперниций Cn.
Атомные веса: Zn — 65,37, Cd — 112,4, Hg — 200,59.
Электроны по энергетическим уровням распределяются так, что на внешнем энергетическом уровне располагаются 2 электрона, находящихся на s-оболочке (табл.).
Валентными в атомах элементов в данной подгруппе являются лишь электроны внешнего электронного слоя.
Электроны пред внешнего слоя в образовании валентных связей не участвуют в отличие от элементов побочной подгруппы I группы.
Таблица распределения электронов по энергетическим уровням элементов побочной подгруппы II группы
| Элемент | Заряд ядра | Число электронов на энергетических уровнях | Радиус атома A | ||||||
| K | L | M | N | O | P | Q | |||
| Цинк Zn | + 30 | 2 | 8 | 18 | 2 | 1.33 | |||
| Кадмий Cd | +48 | 2 | 8 | 18 | 18 | 2 | 1.49 | ||
| Ртуть Hg | +80 | 2 | 8 | 18 | 32 | 18 | 2 | 1,50 | |
С возрастанием заряда ядра от цинка к ртути снижается восстановительная активность. Цинк в ряду напряжений располагается левее водорода.
Физические свойства элементов подгруппы цинка приведены в табл. 2.
Таблица физических свойств элементов подгруппы цинка
| Элемент | Порядковый номер | Атомный вес | Температура плавления, °С | Температура кипения, °С | Плотность, г/смЗ |
| Цинк Zn | 30 | 65,3 | 419,4 | 906 | 7,1 |
| Кадмий Cd | 48 | 112,4 | 320,9 | 767 | 8,6 |
| Ртуть Hg | 80 | 200,5 | -38,84 | 356,95 | 14,0 |
Из элементов подгруппы цинка наибольшее значение имеют цинк и ртуть, поэтому мы в основном остановимся на этих металлах.
➡️ 23. Сравните величину радиусов атомов щелочноземельных металлов и металлов подгруппы цинка, находящихся в одних и тех же периодах.
Объясните, почему при одинаковой структуре внешнего электронного слоя элементы подгруппы цинка проявляют меньшую восстановительную активность.
24. Изобразите электронные конфигурации внешнего и пред внешнего слоя атомов элементов подгруппы цинка и распределение электронов по орбиталям. Отметьте их сходство и различие.
Цинк Zn
Цинк Zn — тяжелый цветной металл, химически активен, обладает хорошо выраженными восстановительными свойствами.
Подобно алюминию, он покрыт защитной пленкой окиси, однако реагирует с кислородом при нагревании и даже может гореть в кислороде с образованием окиси цинка ZnO:
2Zn + О2 = 2ZnO
В соединениях цинк постоянно двухвалентен.
Это металл серебристо-голубоватого цвета. В соединениях проявляет степень окисления +2. Из девяти радиоактивных изотопов важнейший изотоп 65Zn с периодом полураспада 250 дней.
Важнейший минерал цинка — сфалерит (цинковая обманка). В виде соединений цинк находится в полиметаллических рудах, содержащих свинец, медь и железо.
Если смешать тонкий порошок металлического цинка с мелко растертой серой и нагреть, то происходит бурная реакция, сопровождающаяся яркой вспышкой, образуется сульфид цинка белого цвета.
Например:
Zn + S = ZnS
С галогенами цинк реагирует без нагревания:
Zn + Cl2 = ZnCl2
Взаимодействие цинка с водой практически прекращается сразу после начала реакции, так как на поверхности металла образуется плотная пленка гидроокиси цинка, которая прекращает доступ воды к металлу.
Однако если вода берется в виде перегретого пара, а цинк — сильно раскаленный, то идет реакция с образованием окиси цинка:
Zn + H2O = ZnO + H2↑
С кислотами цинк активно реагирует с вытеснением водорода.
Реакция цинка Zn с соляной кислотой НСl идет при обычных условиях и служит общеизвестным способом получения водорода в лаборатории:
Zn + 2НСl = ZnCl2 + H2↑
Zn + 2H+ = Zn2+ + H2↑
При взаимодействии с концентрированной серной кислотой цинк в зависимости от концентрации кислоты и других условий может восстанавливать серу до сероводорода, до свободной серы или до двуокиси серы.
Например:
Zn + H2SO4 → … (S+4)
Zn + H2SO4 → … (S-2)
Zn + H2SO4 → … (S0)
▷ Самостоятельно составьте полные уравнения и расставьте коэффициенты на основе электронного баланса.
Особенностью цинка является его амфотерность.
Наряду с реакцией между цинком и кислотами легко происходит реакция между цинком и щелочами.
При этом цинк вытесняет из щелочей водород и образует соли — цинкаты:
Zn + 2NaOH = Na2ZnO2 (цинкат натрия) + H2↑
Zn + 2Na+ + 2OH— = 2Na+ + ZnO22— + H2↑
Zn + 2OH— = ZnO22— + H2↑
➡️ 25. Перечислите особенности химических свойств цинка, подтвердите их уравнениями реакции и обоснуйте с позиции теории строения атомов.
Составьте план изложения этого вопроса. (См. Ответ)
Оксид и гидроксид цинка
Окись цинка ZnO с водой в реакцию не вступает, однако обладая амфотерным характером, может вступать в реакцию как с кислотами.
Пример:
ZnO + H2SO4 = ZnSO4 + Н2O
ZnO + 2Н+ + SO24— = Zn2+ + SO24— + H2O
ZnO + 2H+ = Zn2+ + H2O
так и со щелочами:
ZnO + 2NaOH = Na2ZnO2 + H2O
ZnO + 2Na+ + 2OH— = 2Na+ + ZnO22— + H2O
ZnO + 2OH— = ZnO22— + H2O
Окись цинка широко используется для изготовления нетемнеющих цинковых белил.
При сильном нагревании с углем окись цинка может быть восстановлена до свободного цинка:
ZnO + С = Zn + СО
Окись цинка иногда встречается в природе.
Гидроокись цинка Zn(OH)2 — также вещество амфотерное, нерастворимое в воде, но хорошо растворимое как в кислотах.
Например:
Zn(OH)2 + 2Н+ = Zn2+ + 2Н2O
так и в щелочах:
Zn(OH)2 + 2OН— = ZnO22— + 2Н2O
▷ На основании приведенных сокращенных ионных уравнений составьте полные ионные и молекулярные уравнения.
Соли цинка
Из солей цинка важнейшими являются хлорид ZnCl2 и сульфат ZnSO4.
Сульфат цинка (цинковый купорос) поступает в лаборатории в виде кристаллогидрата ZnSO4 • 7H2O. Разбавленные растворы применяются как лекарственное средство при некоторых заболеваниях.
Как уже указывалось, сульфат цинка используют для получения металлического цинка путем электролиза, а также как протраву при крашении тканей.
Хлорид цинка ZnCl2 — «травленая кислота» применяется при паянии, для пропитки древесины с целью предохранения ее от гниения, в производстве пергамента.
Цинк в природе встречается в виде минерала цинковой обманки ZnS, которая является цинковой рудой.
Цинк из нее получают посредством обжига на воздухе с последующим восстановлением полученной окиси углем.
Например:
2ZnS + 3O2 = 2SO2 + 2ZnO ZnO + С = Zn + СО
Образовавшуюся окись иногда при наличии дешевой электроэнергии переводят серной кислотой в сульфат, а затем последний подвергают электролизу.
Свободный цинк широко применяется в промышленности.
Благодаря способности образовывать на поверхности металла защитную окисную пленку цинком покрывают изделия из железа для защиты от коррозии посредством погружения их в расплавленный цинк (цинкование).
Чистый цинк довольно хрупок, поэтому чаще он применяется в составе сплавов, например латуни .
Соединения цинка имеют гораздо более ограниченное применение по сравнению с чистым металлом.
➡️ 26. Что такое амфотерность и как она проявляется в соединениях цинка? (См. Ответ)
27. Укажите способы получения окиси и гидроокиси цинка.
28. Почему цинковая посуда портится при добавлении в нее при стирке уксуса или щелочи? Можно ли в цинковой посуде держать раствор медного купороса?
29. Каким простейшим способом можно освободить раствор сульфата цинка от примеси раствора сульфата меди? (См. Ответ)
Ртуть Hg
Ртуть — единственный металл, находящийся при обычной температуре в жидком состоянии (температуре плавления — 38,8°). Ртуть белого цвета.
Она обладает меньшей восстановительной активностью, чем цинк. В ряду напряжений ртуть располагается правее водорода, т. е. не вытесняет его из воды и кислот.
Радиус атома ртути почти равен радиусу атома кадмия, а заряд ядра атома значительно больше, поэтому электроны внешнего слоя удерживаются ртутью значительно прочнее.
➡️ 30. Изобразите электронную конфигурацию внешнего и пред внешнего слоя атома ртути. Объясните, почему среди металлов группы цинка ртуть проявляет наименьшую восстановительную активность. (См. Ответ)
Соединения ртути
Ртуть легко образует с другими металлами сплавы, которые называются амальгамами.
Ртуть химически малоактивна и на воздухе без изменений может храниться довольно долго.
При длительном слабом нагревании ртути с кислородом (воздухом) может окисляться, образуя окись ртути:
2Hg + O2 = 2HgO
При растирании в ступке ртуть очень легко взаимодействует с серой, образуя сульфид ртути (II) черного цвета:
Hg + S = HgS
С водой ртуть в реакцию не вступает, но хорошо реагирует с азотной и концентрированной серной кислотами, обладающими сильным окисляющим действием.
При этом в зависимости от того, при какой температуре ведется реакция, образуются соли как одновалентной, так и двухвалентной ртути.
Ртуть в соединениях может быть одновалентной и двухвалентной.
Соединения как одновалентной, так и двухвалентной ртути достаточно устойчивы, хотя и могут превращаться друг в друга.
Следует отметить сильную ядовитость ртути, которая даже при комнатной температуре легко испаряется и может вызвать тяжелые отравления, оказывающие сильное влияние на сердце.
При попадании соединений ртути внутрь возникает расстройство деятельности органов пищеварения и почек.
Очень ядовиты и соединения ртути, такие, как, например, сулема.
В промышленности применяется как металлическая ртуть, так и некоторые ее соли.
Металлическую ртуть используют при изготовлении термометров, барометров и некоторых измерительных приборов.
А также при добыче золота для его очистки от примесей, так как ртуть легко образует амальгамы с золотом и некоторыми другими драгоценными металлами.
Этим ее свойством пользуются и в зубоврачебной практике для изготовления пломб.
Соли ртути также находят некоторое применение. Например, сулема HgCl2 используется как дезинфицирующее средство, каломель Hg2Cl2(Cl — Hg — Hg — Cl) — как легкое слабительное.
Получение
В природе ртуть встречается изредка в самородном жидком состоянии, но чаще в виде соединений, например киновари HgS.
Для получения из нее ртути киноварь сначала обжигают:
2HgS + 3O2 = 2HgO + 2SO2
а затем полученную окись ртути HgO разлагают нагреванием:
2HgO = 2Hg + O2
Обычно обе реакции протекают одновременно в едином процессе.
➡️ 31. Что такое амальгамы? С какой амальгамой вы уже знакомы? (См. Ответ)
32. Перечислите особенности химических свойств ртути.
33. Каково физиологическое действие ртути?
34. Укажите, где применяется металлическая ртуть.
35. Что вам известно о соединениях ртути?
36. В каком виде ртуть может встречаться в природе и как можно получить ее из природных соединений? Подтвердите свой ответ уравнениями реакций.
37. Основываясь на положении ртути в ряду напряжений металлов, опишите отношение ртути к воде, соляной кислоте, разбавленной и концентрированной серной кислоте, разбавленной и концентрированной азотной кислоте. (См. Ответ)
Титан Ti (побочная подгруппа IV группы)
Титан Ti — элемент побочной подгруппы IV группы периодической системы. Атомный вес 47,9, заряд ядра + 22.
Электроны распределены по четырем энергетическим уровням:
➡️ 38. Изобразите электронную конфигурацию внешнего и пред внешнего слоев и распределение электронов по орбиталям.
Незавершенностью d-орбиталей пред внешнего слоя объясняется то, что в образовании валентных связей участвуют не только два электрона внешнего слоя, но и два электрона пред внешнего слоя.
B связи с этим титан может быть в соединениях как двухвалентным, так и (гораздо чаще) четырехвалентным.
Соединения четырехвалентного титана более устойчивы.
Титан довольно легкий металл с плотностью 4,5. Он плавится при температуре 1670°, а кипит при 3260°. Титан пластичен, обладает хорошей ковкостью.
Чем выше температура, тем сильнее проявляются восстановительные свойства титана.
Свойства
На холоде он сравнительно мало активен, но при нагревании легко взаимодействует с галогенами, кислородом, проявляя при этом степень окисления + 4.
Из реакций со сложными веществами следует отметить взаимодействие с перегретым водяным паром:
Ti + 2H2O = TiO2 + 2H2↑
Интересно, что титан гораздо активнее реагирует с газообразными галогеноводородами, чем с аналогичными кислотами.
Например, с хлористым водородом при нагревании идет реакция:
Ti + 4НСl = TiCl4 + 2H2↑
в то время как соляная кислота действует на титан только в концентрированном виде.
Кислородные кислоты с сильными окислительными свойствами в основном вступают с титаном в окислительно-восстановительные реакции:
Ti + HNO3 → H2TiO3 (титановая кислота) + NO
Ti + H2SO4 → Ti(SO4) (сульфат титана) + SO2
▷ Закончите составление уравнений окислительно-восстановительных реакций самостоятельно.
Однако на гладкой поверхности изделий из титана или его сплавов такие кислоты могут образовывать оксидную пленку, защищающую металл от дальнейшего окисления.
Высший окисел титана ТiO2 носит в основном кислотный характер.
Ему соответствует титановая кислота Н2TiO3, соли которой носят название титанатов, например:
- Титанат железа FeTiO3.
- Титанат кальция CaTiO3.
При сплавлении ТiO2, с некоторыми основными окислами, например с СаО, образуются соответствующие титанаты:
СаО + ТiO2 = CaTiO3
Распространение получение применение титана
В природе титан довольно распространен. Он встречается в виде минерала рутила, в основе которого двуокись титана ТiO2, а также в виде титанатов кальция и железа.
Минералы, содержащие титан, часто сопутствуют железным рудам и редко встречаются в виде крупных самостоятельных месторождений.
Получают титан из природных соединений, переводя их в хлорид TiCl4, а затем восстанавливая из хлорида расплавленным магнием:
TiCl4 + 2Mg = Ti + 2MgCl2 Это весьма дорогой способ.
Титан применяют в основном в качестве добавок к сплавам, в частности к стали, что придает ей ковкость, жаропрочность, устойчивость к коррозии.
➡️ 39. Подробно опишите химические свойства титана. Чем титан отличается от цинка и в чем они сходны?
40. Что такое титанаты и как можно их получить?
41. Каким способом можно получить титан из природных соединений?
42. Где применяется титан? (См. Ответ)
Статья на тему Цинк. Подгруппа цинка