Теория:
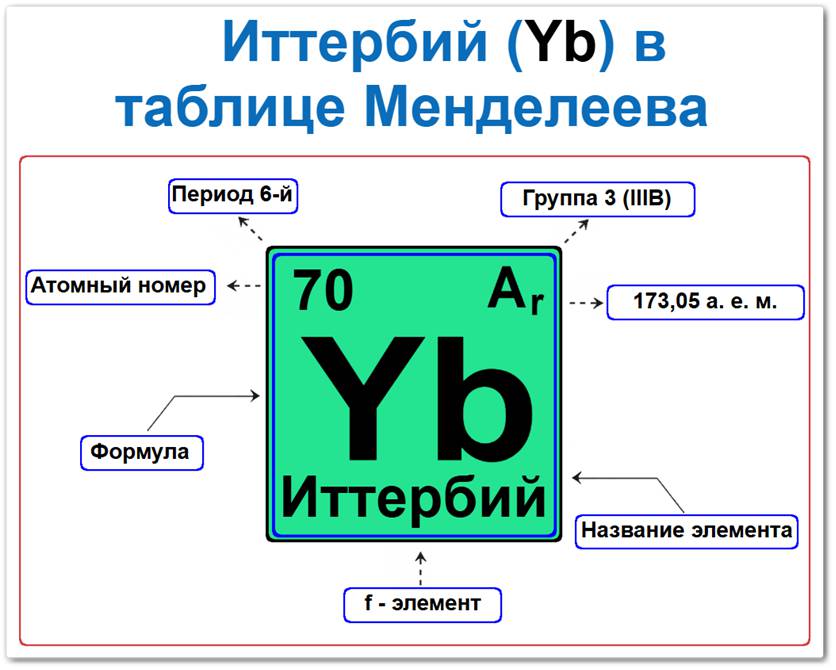
Иттербий (Yb) в периодической системе: 6‑й период, 3‑я группа (по устаревшей классификации — III B), атомная масса 173,05 а.е.м.
Занимает положение в 6-м периоде, что относит его к семейству лантаноидов — редкоземельных элементов, расположенных в нижней части таблицы.
Будучи типичным представителем f-блока, иттербий проявляет свойства мягкого, серебристо-белого металла, который, в отличие от многих других лантаноидов, обладает высокой пластичностью.
Благодаря своей электронной конфигурации, иттербий имеет одну из самых низких температур кипения среди лантаноидов и уникальные магнитные свойства.
Его нахождение в ряду лантаноидов (в классической системе — побочная подгруппа III группы) задает ключевые параметры:
Наиболее характерную валентность III, а также устойчивое состояние II.
Способность образовывать оксиды состава Yb2O3 и солеобразные соединения, где проявляется его высокая химическая активность.
Структура атома подтверждается её электронной формулой (конфигурацией):
[Xe] 4f14 6s2.
На которой наглядно можно определить его положение как f-блочного элемента, завершающего заполнение 4f-подуровня перед Лютецием.
Иттербий в таблице Менделеева можно определить на основании закона периодичности: положение в ряду лантаноидов период 6, группа III / Лантаноиды, а также порядкового номера / атомный номер (Z = 70).
Как определить положение Иттербия в Таблице Менделеева
Локация иттербия в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (формально — III группа, семейство лантаноидов).
- Период (горизонтальный ряд — 6-й).
- Электронное семейство (иттербий — f-элемент).
Порядковый номер / атомный номер (Z = 70)
- Служит уникальным кодом элемента в системе.
- В ядре — 70 протонов; в нейтральной оболочке — 70 электронов.
- Электронное строение: [Xe] 4f14 6s2.
Важно: Полностью заполненная 4f-оболочка (14 электронов) делает иттербий одним из самых стабильных лантаноидов в плане электронной конфигурации.
Название и символ
- Название: «иттербий» (назван в честь деревни Иттербю в Швеции, где был найден минерал гадолинит).
- Символ: Yb.
- Примечание: Элемент был открыт Жаном Мариньяком в 1878 году и стал важным компонентом в производстве лазеров и оптоволокна.
Группа (III / Лантаноиды)
Расположен в ряду лантаноидов, которые вынесены за пределы основной таблицы, но по химическим свойствам принадлежат к III группе.
Химический потенциал:
- Валентность иттербия: типичная валентность III, но часто проявляет валентность II из-за устойчивости заполненного f-подуровня.
- Степень окисления: +3 и +2. Соединения иттербия (+2) являются сильными восстановителями.
Период (6-й)
Находится в 6-м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Лантаноидное сжатие: Как и другие элементы этого ряда, иттербий имеет меньший атомный радиус, чем можно было бы ожидать, из-за слабого экранирования заряда ядра f-электронами.
- Металлические свойства: Несмотря на сложное строение, иттербий остается мягким и ковким металлом, легко поддающимся обработке.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Yb) ≈ 173,05 а.е.м.
- Определение: средневзвешенное значение массы семи стабильных изотопов, среди которых наиболее распространен Yb-174.
Все значения для всех элементов можно узнать в таблице атомных масс.
f-Элемент (электронное семейство)
Застраивающимся является 4f-подуровнь (4f14).
Специфика блока: Будучи f-элементом, иттербий практически завершает ряд лантаноидов. Его полностью заполненная f-оболочка определяет его положение как переходного звена к d-элементам 6-го периода.
Определение энергетических уровней Иттербия по Таблице Менделеева
Положение Иттербия (Yb) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Иттербий относится к шестой строке таблицы. Номер периода определяет число электронных слоев.
- Итог: У Иттербия 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Иттербия — 70. Его 70 электронов распределены по уровням следующим образом:
Yb ) 2 ) 8 ) 18 ) 32 ) 8 ) 2
3. Семейство лантаноидов (Химический характер)
- f-элемент: Основные свойства связаны с заполнением внутреннего 4f-слоя.
- Место в блоке: Является тяжелым лантаноидом, стоящим перед лютецием (Lu) и гафнием (Hf).
Проверка знаний: Как определить иттербий по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Иттербий (Yb) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 70. Главная координата Иттербия.
- 2) 6-й период, лантаноиды. Точное место в системе.
- 3) 4f14 6s2. Формула полностью заполненного f-подуровня.
- 4) Ошибка. Иттербий — лантаноид, а не щелочной металл.
- 5) Ошибка. Гелий в 1-м периоде, иттербий — в 6-м.
- 6) Ошибка. Иттербий — серебристо-белый металл.
Часто задаваемые вопросы:
Иттербий расположен в 6-м периоде. Формально он принадлежит к лантаноидам, порядковый номер — 70.
У иттербия 6 энергетических уровней, так как он находится в 6-м периоде.
Электронная схема: 2, 8, 18, 32, 8, 2.
Это связано с его электронной конфигурацией: при отдаче двух 6s-электронов остается полностью заполненный и очень устойчивый 4f14 подуровень.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.