Теория:
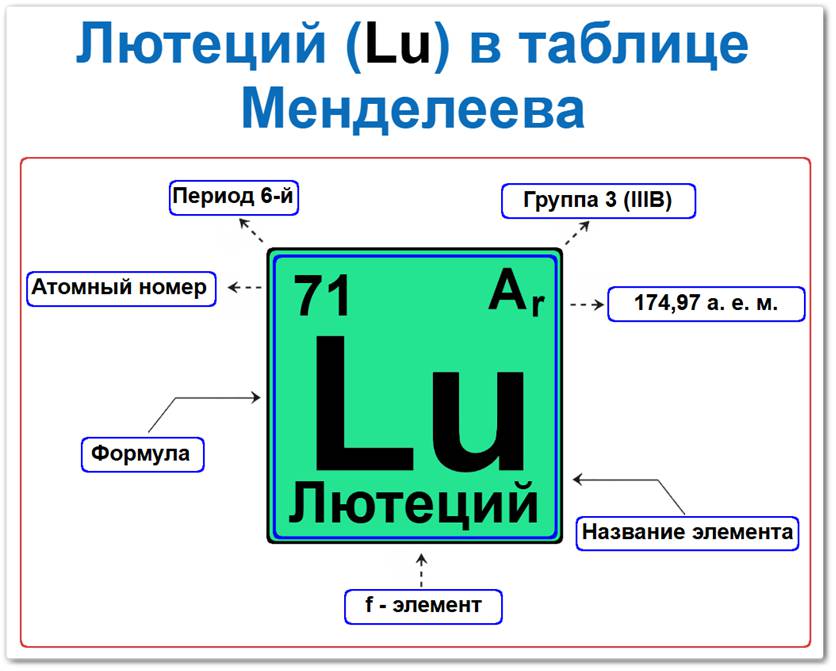
Лютеций (Lu) в периодической системе: 6‑й период, 3‑я группа (по устаревшей классификации — III B), атомная масса 178,49 а.е.м.
Занимает положение в 6-м периоде, являясь последним элементом в ряду лантаноидов.
Это определяет его уникальную природу как самого тяжелого и твердого среди редкоземельных металлов.
Будучи химическим гомологом (аналогом) лантана и иттрия, он завершает семейство лантаноидов, демонстрируя максимальное проявление лантаноидного сжатия.
Из-за полностью заполненной 4f-оболочки лютеций часто рассматривается как мост между лантаноидами и переходными d-металлами, что делает его свойства более похожими на гафний, чем на легкие редкоземельные элементы.
Его нахождение в 3-й группе (ранее — побочная подгруппа III группы) задает ключевые параметры:
Стабильную и практически единственную валентность III.
А также высокую химическую стойкость и тугоплавкость по сравнению с другими лантаноидами.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Xe] 4f14 5d1 6s2.
На которой наглядно можно определить его положение как f-блочного элемента (завершающего ряд), у которого первый электрон начинает заполнять 5d-подуровень.
Лютеций в таблице Менделеева можно определить на основании закона периодичности: положение в группе (3 / III B) и периоде (6‑й), а также порядкового номера / атомного номера (Z = 71).
Как определить положение Лютеция в Таблице Менделеева
Локация лютеция в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд, семейство скандия/иттрия).
- Период (горизонтальный ряд).
- Электронное семейство (лютеций — f‑элемент, завершающий ряд лантаноидов).
Порядковый номер / атомный номер (Z = 71)
- Служит уникальным кодом элемента в системе.
- В ядре — 71 протон; в нейтральной оболочке — 71 электрон.
- Электронное строение: [Xe] 4f14 5d1 6s2.
Важно: Полностью заполненная 4f-оболочка делает лютеций самым химически стабильным среди лантаноидов, лишая его характерных для этой группы магнитных свойств, присущих элементам с неспаренными f-электронами.
Название и символ
- Название: «лютеций» (от латинского «Lutetia» — древнее название Парижа).
- Символ: Lu.
- Примечание: Элемент был открыт в 1907 году независимо тремя учеными, но приоритет закрепился за Жоржем Урбэном.
Группа (3 / III B)
Расположен в 3-й группе; по классической классификации — побочная подгруппа III группы (подгруппа скандия).
Химический потенциал:
- Валентность лютеция: постоянная валентность III.
- Степень окисления: +3. Оксид лютеция (Lu2O3) обладает выраженными основными свойствами и высокой температурой плавления.
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Лантаноидное сжатие: Из-за накопления заряда ядра в 6-м периоде радиус атома лютеция минимален среди всех предшествующих ему лантаноидов. Это делает его самым плотным и твердым в своем ряду.
- Парамагнетизм: В отличие от многих лантаноидов, чистый лютеций проявляет слабый парамагнетизм, так как f-оболочка полностью завершена.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Lu) ≈ 174,97 а.е.м.
- Определение: значение, определяемое стабильным изотопом лютеций-175 и долгоживущим радиоактивным изотопом лютеций-176.
Все значения для всех элементов можно узнать в таблице атомных масс.
f‑Элемент (электронное семейство)
Хотя формально лютеций является f-элементом, его 4f-подуровень полностью заполнен (4f14).
Специфика блока: Завершая f-блок 6-го периода, лютеций фактически открывает путь к заполнению d-оболочки (элемент гафний). Это объясняет его близость по свойствам к d-металлам.
Определение энергетических уровней Лютеция по Таблице Менделеева
Положение Лютеция (Lu) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Лютеций находится в шестой строке таблицы. Номер периода определяет число электронных слоев.
- Итог: У Лютеция 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Лютеция — 71. Его 71 электрон распределен по уровням следующим образом:
Lu ) 2 ) 8 ) 18 ) 32 ) 9 ) 2
Важное отличие: На четвертом уровне у него максимальное число электронов (32), что характерно для завершенного f-ряда.
3. 3-я группа (Химический характер)
Лютеций возглавляет (или завершает, в зависимости от системы) ряд тяжелых редкоземельных металлов.
- f-элемент: Свойства определяются завершенностью 4f-слоя.
- Место в блоке: Является самым труднодоступным и дорогим среди лантаноидов.
Проверка знаний: Как определить лютеций по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Лютеций (Lu) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 71. Главная координата Лютеция.
- 2) 6-й период, 3-я группа. Местоположение в системе редкоземельных металлов.
- 3) Завершает лантаноиды. Последний элемент f-ряда в 6 периоде.
- 4) Ошибка. Лютеций — лантаноид (редкоземельный металл).
- 5) Ошибка. Лютеций — тяжелый элемент 6-го периода.
- 6) Ошибка. Лютеций — очень твердый серебристо-белый металл.
Часто задаваемые вопросы:
Лютеций расположен в 6-м периоде, 3-й группе (побочная подгруппа III группы). Он замыкает ряд лантаноидов. Атомный номер — 71.
У лютеция 6 энергетических уровней, так как он находится в 6-м периоде.
Электронная схема: 2, 8, 18, 32, 9, 2.
Это связано с эффектом лантаноидного сжатия: из-за максимального заряда ядра в ряду f-элементов его атомный радиус минимален, что обеспечивает более плотную упаковку атомов и прочные связи в кристаллической решетке.