Теория:
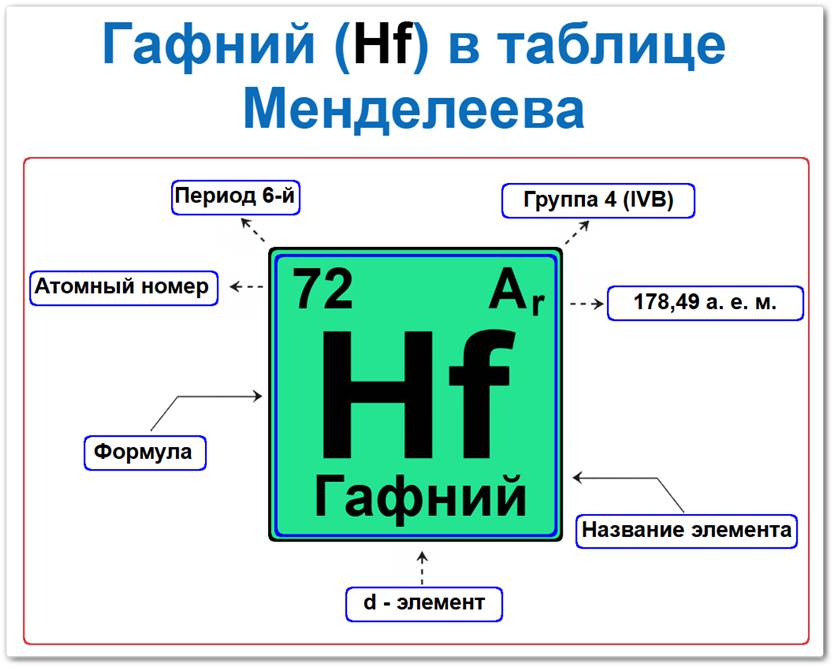
Гафний (Hf) в периодической системе: 6‑й период, 4‑я группа (по устаревшей классификации — IV B), атомная масса 178,49 а.е.м.
Занимает положение в 6‑м периоде, что определяет его свойства как тяжелого тугоплавкого переходного металла с высокой коррозионной стойкостью.
Будучи химическим гомологом (аналогом) циркония, он располагается в одной вертикальной группе с ним, обладая поразительным сходством химических свойств из-за лантаноидного сжатия.
В отличие от ртути, гафний обладает плотной кристаллической решеткой и является одним из самых трудно расплавляемых металлов, что делает его незаменимым в ядерной энергетике и аэрокосмической отрасли.
Его нахождение в 4‑й группе (ранее — побочная подгруппа IV группы) задает ключевые параметры:
Наиболее характерную валентность IV.
А также высокую химическую инертность при нормальных условиях благодаря образованию прочной защитной оксидной пленки.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Xe] 4f14 5d2 6s2.
На которой наглядно можно определить его положение как d-блочного элемента, находящегося в начале 5d-ряда после лантаноидов.
Гафний в таблице Менделеева можно определить на основании закона периодичности: положение в группе (4 / IV B) и периоде (6‑й), а также порядкового номера / атомный номер (Z = 72).
Как определить положение Гафния в Таблице Менделеева
Локация гафния в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд, семейство титана).
- Период (горизонтальный ряд).
- Электронное семейство (гафний — d‑элемент).
Порядковый номер / атомный номер (Z = 72)
- Служит уникальным кодом элемента в системе.
- В ядре — 72 протона; в нейтральной оболочке — 72 электрона.
- Электронное строение: [Xe] 4f14 5d2 6s2.
Важно: Наличие заполненного 4f-подуровня перед валентными d-электронами (лантаноидное сжатие) делает радиус атома гафния почти идентичным радиусу циркония, что затрудняет их разделение в природе.
Название и символ
- Название: «гафний» (от латинского Hafnia — название Копенгагена, где элемент был открыт).
- Символ: Hf.
- Примечание: Открыт только в 1923 году Дирком Костером и Дьёрдем де Хевеши с помощью рентгеноспектрального анализа.
Группа (4 / IV B)
Расположен в 4‑й группе; по классической классификации — побочная подгруппа IV группы (подгруппа титана).
Химический потенциал:
- Валентность гафния: типичная валентность IV.
- Степень окисления: +4. Соединения гафния крайне тугоплавки (например, карбид гафния HfC имеет одну из самых высоких температур плавления).
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Высокая плотность: Положение в нижней части таблицы обуславливает значительную плотность (13,31 г/см3).
- Поглощение нейтронов: Благодаря структуре ядра гафний обладает огромным сечением захвата тепловых нейтронов, что определяет его использование в регулирующих стержнях реакторов.
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(Hf) ≈ 178,49 а.е.м.
- Определение: средневзвешенное значение массы стабильных изотопов гафния.
Все значения для всех элементов можно узнать в таблице атомных масс.
d‑Элемент (электронное семейство)
Застраивающимся является 5d‑подуровнь (5d2).
Специфика блока: Гафний является типичным переходным d-металлом. Его валентные электроны находятся на 5d и 6s подуровнях, что позволяет ему образовывать прочные металлические и ковалентные связи.
Определение энергетических уровней Гафния по Таблице Менделеева
Положение Гафния (Hf) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Гафний находится в шестой строке таблицы. Номер периода определяет число электронных слоев.
- Итог: У Гафния 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Гафния — 72. Его 72 электрона распределены по уровням следующим образом:
Hf ) 2 ) 8 ) 18 ) 32 ) 10 ) 2
3. 4-я группа (Химический характер)
Гафний входит в семейство титана и циркония.
- d-элемент: Активность определяется недостроенной d-оболочкой.
- Место в блоке: Тяжелый аналог циркония (Zr), превосходящий его по тугоплавкости и способности захватывать нейтроны.
Проверка знаний: Как определить гафний по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Гафний (Hf) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 72. Определяет положение после лютеция.
- 2) 6-й период, 4-я группа. Подтверждает его статус тяжелого переходного металла.
- 3) d-элемент. Указывает на заполнение 5d-орбитали.
- 4) Ошибка. Гафний в 4-й группе, а не в 1-й.
- 5) Ошибка. Гафний — тяжелый металл.
- 6) Ошибка. Период 6-й, значит и уровней 6.
Часто задаваемые вопросы:
Гафний расположен в 6-м периоде, 4-й группе (побочная подгруппа IV группы). Атомный номер — 72.
У гафния 6 энергетических уровней, так как он находится в 6-м периоде.
Электронная схема: 2, 8, 18, 32, 10, 2.
Это связано с лантаноидным сжатием: из-за заполнения 4f-подуровня перед гафнием, радиус его атома уменьшается, становясь почти равным радиусу циркония из 5-го периода.