Теория:
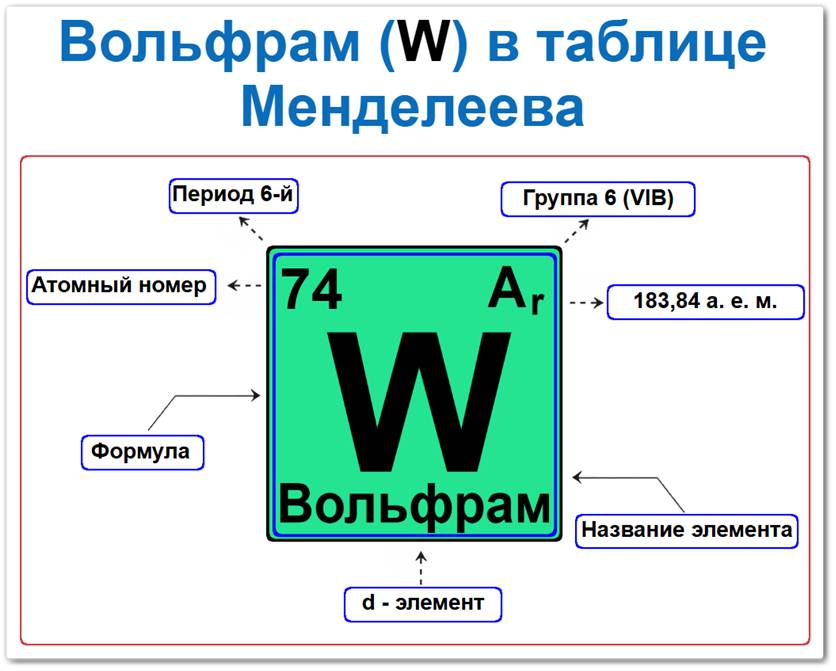
Вольфрам (W) в периодической системе: 6‑й период, 6‑я группа (по устаревшей классификации — VI B), атомная масса 183,84 а.е.м.
Занимает положение в 6‑м периоде, что определяет его уникальную природу как самого тугоплавкого металла из всех существующих элементов.
Будучи химическим гомологом (аналогом) хрома и молибдена, он находится в центре ряда переходных металлов своего периода.
Из-за высокой энергии связи между атомами в кристаллической решетке, вольфрам обладает колоссальной термической и механической стойкостью.
А его нахождение в 6‑й группе (ранее — побочная подгруппа VI группы) задает ключевые параметры:
Наиболее характерную высшую валентность VI.
А также способность образовывать сложные поливольфраматы и сверхтвердые соединения, такие как карбид вольфрама.
Структура атома подтверждается его электронной формулой (конфигурацией):
[Xe] 4f14 5d4 6s2.
На которой наглядно можно определить его положение как d-блочного элемента, находящегося в процессе заполнения 5d-подуровня.
Вольфрам в таблице Менделеева можно определить на основании закона периодичности: положение в группе (6 / VI B) и периоде (6‑й), а также порядкового номера / атомный номер (Z = 74).
Как определить положение Вольфрама в Таблице Менделеева
Локация вольфрама в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (вертикальный ряд, семейство хрома).
- Период (горизонтальный ряд).
- Электронное семейство (вольфрам — d‑элемент).
Порядковый номер / атомный номер (Z = 74)
- Служит уникальным кодом элемента в системе.
- В ядре — 74 протона; в нейтральной оболочке — 74 электрона.
- Электронное строение: [Xe] 4f14 5d4 6s2.
Важно: Наличие четырех неспаренных электронов на 5d-подуровне позволяет вольфраму образовывать очень прочные межатомные связи, что и обуславливает его рекордную температуру плавления (3422°C).
Название и символ
- Название: «вольфрам» (от немецкого Wolf Rahm — «волчья пена»); это связано с тем, что элемент мешал выплавке олова, «пожирая» его.
- Символ: W (от латинского Wolframium).
- Примечание: Широко известен как материал для нитей накаливания в лампах и основа сверхпрочных сплавов.
Группа (6 / VI B)
Расположен в 6‑й группе; по классической классификации — побочная подгруппа VI группы (подгруппа хрома).
Химический потенциал:
- Валентность вольфрама: типичная высшая валентность VI, но также проявляет II, III, IV и V.
- Степень окисления: от +2 до +6. Наиболее устойчив оксид вольфрама (VI) — , который является важным сырьем для получения чистого металла.
Период (6‑й)
Находится в 6‑м периоде — его электроны распределены по шести энергетическим уровням.
Влияние на свойства:
- Тугоплавкость: Положение в середине d-блока 6-го периода обеспечивает идеальный баланс электронов для формирования максимально прочной металлической связи.
- Плотность: Вольфрам — один из самых тяжелых металлов, его плотность практически равна плотности золота (19,25 г/см³).
Все значения элементов в полной сводной таблице параметров химических элементов (Z, Ar, Группа, Период).
Относительная атомная масса (Ar)
- Ar(W) ≈ 183,84 а.е.м.
- Определение: средневзвешенное значение массы пяти стабильных изотопов, встречающихся в природе.
Все значения для всех элементов можно узнать в таблице атомных масс.
d‑Элемент (электронное семейство)
Застраивающимся является 5d‑подуровнь (5d4).
Специфика блока: Будучи d-элементом, вольфрам проявляет типичные свойства переходных металлов: способность к образованию окрашенных соединений и различных степеней окисления.
Определение энергетических уровней Вольфрама по Таблице Менделеева
Положение Вольфрама (W) в системе Менделеева — это готовый «паспорт» его внутреннего устройства.
1. 6-й период (Количество этажей)
Вольфрам находится в шестой строке таблицы. Номер периода определяет число электронных слоев.
- Итог: У Вольфрама 6 энергетических уровней.
2. Список «жильцов» (Распределение электронов)
Атомный номер Вольфрама — 74. Его 74 электрона распределены по уровням следующим образом:
W ) 2 ) 8 ) 18 ) 32 ) 12 ) 2
Для сравнения: У хрома (24), стоящего в той же группе, всего 4 уровня, а вольфрам за счет 6 уровней и заполненного 4f-слоя обладает гораздо большей атомной массой.
3. 6-я группа (Химический характер)
Вольфрам входит в семейство переходных металлов VI B группы.
- d-элемент: Свойства определяются недостроенной d-оболочкой.
- Место в блоке: Является тяжелым аналогом молибдена (Mo), обладая еще большей химической и термической стойкостью.
Проверка знаний: Как определить вольфрам по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Вольфрам (W) в структуре таблицы.
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 74. Основной идентификатор вольфрама.
- 2) 6-й период, 6-я группа. Точные координаты в системе.
- 3) Тугоплавкий металл. Главное физическое свойство, определяющее его применение.
- 4) Ошибка. Вольфрам — переходный металл (d-элемент).
- 5) Ошибка. Магний в 3-м периоде, вольфрам намного сложнее по строению.
- 6) Ошибка. Масса вольфрама велика — более 183 а.е.м.
Часто задаваемые вопросы:
Вольфрам расположен в 6-м периоде, 6-й группе (побочная подгруппа VI группы). Атомный номер — 74.
У вольфрама 6 энергетических уровней, так как он находится в 6-м периоде.
Электронная схема распределения: 2, 8, 18, 32, 12, 2.
Это связано с его положением в 6-й группе: у него 6 валентных электронов, которые образуют максимально возможное количество прочных ковалентных связей в металлическом кристалле.