Алюминий — это легкий металлический элемент с атомным номером 13 и символом Al. Он обладает рядом уникальных свойств, которые делают его крайне востребованным в различных отраслях.
- Отличается низкой плотностью (приблизительно 2,7 г/см³), что делает его идеальным для применения в авиации и автомобильной промышленности, где важна экономия веса.
- Имеет высокую коррозионную стойкость благодаря образованию защитной оксидной пленки на поверхности, что увеличивает его долговечность в различных условиях эксплуатации.
- Обладает отличными электропроводными и теплопроводными свойствами, что делает его популярным в электротехнической и строительной сферах.
- Он легко подвергается механической обработке и может бути сформирован в различные изделия, такие как листы, трубы и профили.
Алюминий свойства нахождение в природе
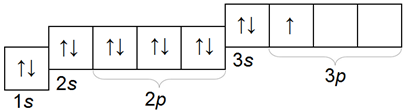
Что такое алюминий — это элемент третьего периода. Заряд ядра атома +13. Электроны располагаются на трех энергетических уровнях: 2, 8, 3.
Электронная конфигурация атома алюминия (1s22s22p63s23р1):
Алюминий принадлежит к семейству р-элементов.
Валентные электроны алюминия располагаются на s-оболочке и р-оболочке внешнего электронного слоя.
Этих электронов три, поэтому алюминий может образовывать три валентных связи, что для него наиболее типично.
Единственная степень окисления алюминия, которую он может проявлять, не считая нейтрального состояния, равна +3.
Таким образом, в окислительно-восстановительных процессах алюминий ведет себя как восстановитель.
➡️73. Почему алюминий относится к р -элементам? (См. Ответ)
74. Какие степени окисления возможны для алюминия?
75. Начертите схему строения Аl+3.
76. Каково поведение алюминия в окислительно-восстановительных реакциях?(См. Ответ)
Физические свойства
Алюминий Al — это серебристо-белый металл. Его атомный вес 26,98. Плотность алюминия 2,7, температура плавления 660°, температура кипения 2060°.
Алюминий принадлежит к группе легких металлов.
Алюминий обладает высокой электропроводностью, равной 0,6 электропроводности меди, поэтому при большем сечении алюминиевых проводов электропроводность их равна медным, а вес гораздо меньше.
В настоящее время это один из самых дешевых и широко распространенных металлов.
Химические свойства
По химическим свойствам алюминий принадлежит к числу весьма активных металлов, обладающих амфотерными свойствами.
В ряду активности он занимает место за щелочноземельными металлами.
Но в чистом виде как на воздухе, так и в воде он может храниться очень долго, так как его поверхность со временем покрывается тонким и очень прочным слоем окиси, которая предохраняет его от окисления.
Для того чтобы наблюдать окисление алюминия на воздухе, необходимо сначала освободиться от защитной пленки.
Для этого алюминий сначала протирают наждачной шкуркой, а затем кипятят в щелочи.
Окись алюминия, как и сам металл, проявляет амфотерные свойства, а потому растворяется в щелочи.
После этого алюминий опускают в раствор какой-либо соли ртути, например нитрата ртути Hg(NO3)2.
Алюминий как более активный металл вытесняет ртуть из ее соли:
2Аl + 3Hg(NO3)2 = 2Al(NO3)3 + 3Hg
Ртуть отлагается на поверхности алюминия, образуя сплав алюминия с ртутью — алюминиевую «амальгаму» (сплавы ртути с металлами называются амальгамами).
Такой сплав не способен образовывать защитную пленку окиси, а алюминий в амальгаме постепенно окисляется до окиси алюминия по уравнению:
4Аl + 3O2 = 2Аl2O3
Но поскольку амальгама покрывает алюминий неравномерно, окисление идет местами и окись алюминия заметна на поверхности металла в виде пушистой щетки (рис. 3).
Интересно взаимодействие алюминия с галогенами — с бромом и йодом.
Для реакции используются порошкообразный алюминий и жидкий бром, а для реакции с йодом— смесь порошка йода с алюминием.
Во всех случаях алюминий ведет себя как восстановитель.
Рис. 3. Образование окиси алюминия на амальгированной поверхности металл.
При высокой температуре алюминий вытесняет некоторые металлы из их окислов. Это свойство нашло применение.
Если смешать окись железа с алюминиевым порошком и поджечь с помощью магниевой вспышки, то произойдет реакция:
Fe2О3 + 2Аl = Аl2O3 + 2Fe
которая сопровождается выделением большого количества тепла.
За счет этого тепла образующееся свободное железо плавится и может быть выпущено из тигля, в котором происходит реакция, через находящееся внизу отверстие.
Такая выплавка металлов называется алюминотермией; в технике она применяется очень широко.
Некоторые металлы можно получить только алюминотермическим путем. Этот процесс был впервые осуществлен Н. Н. Бекетовым.
Алюминий является амфотерным металлом. В различных условиях он ведет себя по-разному.
В растворе щелочи алюминий вытесняет из воды водород, образуя соль алюминиевой кислоты — алюминат натрия (или калия), в котором он играет роль кислотообразующего элемента:
2Аl + 2NaOH + 2Н2O = 2NaAlO2 + 3H2↑
Из кислоты алюминий вытесняет водород:
2Аl + 6НСl = 2АlСl3 + 3H2↑
В этом случае он проявляет металлические свойства.
Концентрированные азотная и серная кислоты на алюминий не действуют, так как на его поверхности образуется защитная пленка, предохраняющая металл от дальнейшего окисления.
В разбавленном виде азотная кислота на алюминий также не действует, а серная действует в слабой степени.
➡️77. Перечислите химические свойства алюминия и обоснуйте свой ответ уравнениями реакций. (См. Ответ)
78. Почему ртуть называют «алюминиевым ядом»?
79. Почему бытовые изделия из алюминия служат длительное время и не подвергаются окислению?
80. Что такое алюминотермия?
81. Сухая смесь состоит из порошков алюминий, железа и угля. При обработке 6 г этой смеси соляной кислотой выделилось 4,48 л водорода, а при обработке того же количества смеси раствором едкого кали — 3,36 л водорода. Определите состав смеси в граммах.
82. Имеется 200 г пиролюзита, содержащего 87% двуокиси марганца. Сколько алюминия потребуется для восстановления из него марганца алюминотермическим путем.
83. Как следует обработать алюминий, чтобы он окислялся на воздухе?
84. В трех пробирках находятся разбавленные кислоты — соляная, серная и азотная. Как, имея кусочки алюминия, определить, в какой пробирке какая кислота?
85. Сколько алюмината натрия получится при взаимодействии со щелочью 27 г алюминия? (См. Ответ)
Соединения алюминия алюминий в природе
Окись и гидроокись алюминия являются ярко выраженными амфотерными соединениями. Они легко вступают во взаимодействие как со щелочами, так и с кислотами.
Молекулу гидроокиси алюминия можно представить в двух формах — в форме основания Аl(ОН)3 и в форме кислоты Н3АlO3.
В тех случаях, когда гидроокись алюминия попадает в кислоту, она ведет себя как основание:
Аl(ОН)3 + 3HCl = АlСl3 + 3Н2O
При взаимодействии с сильными щелочами гидроокись алюминия реагирует как кислота:
Н3АlO3 + 3NaOH = Na3AlO3 + 3Н2O
▷ Оба уравнения напишите в ионной форме.
Получается соль трехосновной ортоалюминиевой кислоты, называемая ортоалюминатом натрия. Но такой состав у солей бывает редко.
Чаще всего ортоалюминиевая кислота в щелочной среде распадается по уравнению:
Н3АlO3 = Н2O + НАlO2
образуя одноосновную метаалюминиевую кислоту НАlO3. Соли этой кислоты называются метаалюминатами, или просто алюминатами.
Реакция между метаалюминиевой кислотой и щелочью выражается следующим уравнением:
НАlO2 + NaOH = NaAlO2 + Н2О
Совершенно так же ведет себя окись алюминия. В кислотах как основной окисел она образует соли алюминия:
Аl2O3 + 6НСl = 2АlСl3 + 3Н2O
в щелочах же — как кислотный окисел и образует алюминаты щелочных металлов:
Аl2O3 + 2NaOH = 2NaAlO2 + Н2O
Алюминат натрия, попадая в кислую среду, претерпевает немедленное превращение:
2NaAlO2 + H2SO4 = Na2SO4 + 2НАlO2
НАlO2 + Н2О = Аl(ОН)3
2Аl(ОН)3 + 3H2SO4 = Al2(SO4)3 + 6Н2O
Таким образом, в конечном итоге получаются следующие продукты:
2NaAlO2 + 4H2SO4 = Na2SO4 + Al2(SO4)3 + 4H2O
▷ Напишите приведенные уравнения реакций в ионной форме.
➡️ 86. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
Аl → АlСl3 → Аl(ОН)3 → NaAlO2 → Al2(SO4)3 (См. Ответ)
(все уравнения записывайте в полной и сокращенной ионной форме).
87. Имеются алюминий, соляная кислота, едкий натр. Как можно получить гидроокись алюминия?
88. Какова нормальность раствора едкого натра, если на растворение 39 г гидроокиси алюминия израсходовано 200 мл этого раствора?
89. Докажите при помощи уравнений реакций, что окись и гидроокись алюминия — амфотерные соединения.
90. Получится ли алюминат натрия, и если да, то в каком количестве, если на 15 г сульфата алюминия подействовать 50 г едкого натра? (См. Ответ)
Применение
Среди соединений алюминия выделяются лишь некоторые его соли.
Особенно важен хлорид алюминия АlCl3, незаменимый в промышленности органического синтеза, где он играет роль катализатора во многих процессах.
Сульфат алюминия Al(SO4)3 · 18Н2О применяется как коагулянт при очистке водопроводной воды, а также в производстве бумаги.
Двойная соль алюминия и калия — алюмокалиевые квасцы KAl(SO4)2 · 12Н2O обладает высокими вяжущими свойствами.
Применяется при дублении кожи, а также в медицинской практике как кровоостанавливающее средство.
В природе алюминий встречается очень широко и по распространенности элементов стоит на третьем месте.
Вследствие высокой химической активности алюминий в природе встречается только в виде соединений.
Он входит в состав алюмосиликатов — глины, слюды, полевого шпата, каолина и др.
Главной алюминиевой рудой является боксит АlO3 · nН2O, из которого получают алюминий при участии другого соединения алюминия — криолита AlF3 · 3NaF.
Твердая кристаллическая окись алюминия, окрашенная примесью окиси железа в желто-бурый цвет, называется корундом.
Корунд обладает высокой твердостью, поэтому применяется для изготовления шлифовальных кругов, брусков и т. д.
Прозрачные кристаллы корунда, окрашенные незначительными примесями, представляют собой драгоценные камни: рубин — красного, сапфир — синего цвета.
Производство и применение алюминия
Металлический алюминий получают электролизом раствора окиси алюминия, называемой глиноземом, в расплавленном криолите.
Окись алюминия добывают из боксита путем длительной очистки, а криолит получают либо из природного минерала, либо искусственным путем, причем последний способ в настоящее время даже дешевле.
Процесс ведут в электрических печах при температуре около 1000°, силе тока около 50 000 а и напряжении 4—5 в (рис. 4).
Применяется алюминий главным образом в виде сплавов с другими металлами, так как он слишком мягок.
Наиболее распространенными сплавами являются силумин — сплав алюминия с кремнием, дюралюминий, в состав которого, помимо алюминия, входят небольшие количества магния, железа, меди, марганца, магналий — сплав алюминия с магнием.
Все эти сплавы легкие и прочные.
Силумин применяется главным образом для литья, дюралюминий и магналий — в самолетостроении, машиностроении, судостроении, для изготовления посуды.
Алюминием покрывают поверхность стальных и железных изделий, что предохраняет их от коррозии.
Для этого стальное изделие выдерживают некоторое время в расплавленном алюминии или нагревают в порошке алюминия, который образует на поверхности сплав с металлом.
Рис. 4. Схема промышленной установки для получения алюминия электролизом.
1 — крепление для анода; 2 — штырь для подключения к сети угольного анода; 3 — корка застывшего электролита; 4 — наружный кожух; 5 — кирпичные стенки; 6 — графитовая обкладка; 7, 8 — катод; 9 — расплавленный алюминий; 10 — расплавленный электролит.
Такие изделия не окисляются даже при высокой температуре. Этот способ предохранения металлов от окисления называется алитированием.
Алюминий широко применяется для изготовления проводов в электротехнике и алюминиевых выпрямителей.
Алюминиевая пыль — как краска для имитации под серебро, алюминиевый порошок — при алюминотермической сварке металлов.
➡️ 91. Глинозем содержит 91,8% окиси алюминия. Сколько можно получить алюминия из 2 т глинозема, если выход алюминия составляет 80% теоретического?
92. Используя материал составьте и заполните таблицу. (См. Ответ)
Применение алюминия
| Свойства алюминия | Использование алюминия, с учетом его свойств |
93. Используя материал, составьте и заполните таблицу.
Свойства соединений алюминия
| Формула соединения | Название | Встречается ли в природе и в виде какого минерала | Наиболее важное свойство | Примечание |
Статья на тему Алюминий Свойства




Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.