Металлическая связь это связь, которая удерживает вместе много металлических атомов в любом металлическом веществе.
Обычно самый внешний электрон каждого из металлических атомов отделяется от атома и перекрывается с большим количеством соседних металлических атомов, не будучи связанным с какой-либо конкретной парой атомов.
Другими словами, валентные электроны металлов, образующие металлические связи, не локализованы и способны свободно блуждать по всему кристаллу, образованному такой связью.
Для образования необходимы два условия:
- Свободные валентные орбиты.
- Низкая энергия ионизации.

Что такое металлическая связь
Все элементы стремятся получить восемь электронов в своей внешней оболочке или валентной оболочке.
Чтобы попытаться получить восемь электронов в их валентной оболочке, атомы всех элементов пытаются образовать связи с другими совместимыми атомами.
Они образуют связи либо путем пожертвования электронов, либо путем обмена электронами.
В случае простых металлов, таких как натрий, он отдает электрон и получает положительный заряд.
А затем образует соединения с такими элементами, как хлор, который получает электрон и получает отрицательный заряд.
Этот вид связи называется ионной связью.
Иногда атомы, такие как водород и кислород, разделяют электроны, чтобы заполнить их валентную оболочку.
Этот вид связи называется ковалентной связью.
Иногда большое количество металлических атомов собирается вместе, и многие электроны в их валентных оболочках отделяются и бродят вокруг оставшихся положительных ионов, таким образом разделяясь между всеми из них.
Этот вид связи называется металлической связью.
Характерные свойства металлов
Вероятно, наиболее наглядным свойством металлов является их способность к отражению света, или блеск.
Почти все металлы (за исключением золота, меди, висмута и марганца) имеют серебристый белый цвет за счет отражения видимого света любых частот.
Мы раньше говорили, что электронная конфигурация вещества определяет характер его взаимодействия со светом.
Очевидно, специфическое отражение света металлами указывает на то, что все металлы имеют электронную конфигурацию особого типа.
Второе характерное свойство металлов — высокая электропроводность.
Их электропроводность настолько выше электропроводности водных растворов электролитов, что перенос зарядов в обоих случаях не может происходить по общему механизму.
На основании этого свойства также можно считать, что металлы имеют электронную конфигурацию особого типа.
Кроме того, металлы имеют необычно высокую теплопроводность. Каждый, кто пил горячий кофе из оловянной чашки, мог в этом убедиться.
Металлы с наиболее высокой электропроводностью лучше других проводят и тепло.
Это говорит о том, что электропроводность и теплопроводность каким-то образом связаны друг с другом, что тоже зависит от электронной конфигурации.
Хотя механические свойства различных металлов неодинаковы, все металлы могут быть вытянуты в проволоку и расплющены в тонкие листы.
Мы отметим еще и четвертое характерное свойство металлов — они легко поддаются обработке.
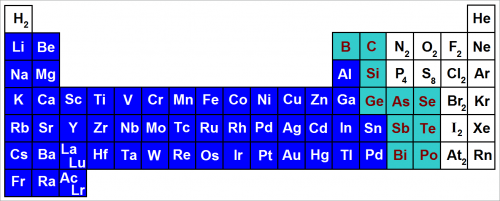
Положение металлов в периодической таблице
Положение металлов в периодической таблице показано на рисунке выше.
Мы видим, что металлы сосредоточены в левой части периодической таблицы, в то время как неметаллы располагаются исключительно в верхнем правом углу.
Кроме того, элементы левой части таблицы имеют относительно низкую энергию ионизации.
Низкая энергия ионизации металлов объясняет многие особенности их поведения.
Поведение электронов в металлах. Какова природа металлической связи?
Эта связь, так же как и все другие типы связей, образуется в результате того, что электроны могут двигаться таким образом, что находятся около двух и более положительных ядер одновременно.
Объяснение свойств металлов
Существованием нелокализованных, или подвижных, электронов объясняются многие характерные свойства металлов.
Поскольку металлические связи не имеют резко выраженного направленного характера, многие кристаллы можно легко деформировать, не нарушая их кристаллической структуры.
Под действием нагрузок одна плоскость кристаллической решетки, состоящая из атомов, может скользить по другой, но при этом электроны способны еще сохранять связь между двумя плоскостями.
Металлы можно сделать более твердыми путем введения в них добавок элементов, которые способствуют образованию направленных ковалентных связей.
Часто при добавлении даже следов углерода, фосфора или серы относительно мягкие и легко поддающиеся обработке металлы становятся очень хрупкими.
Проводимость электрического тока
Металлы проводят электрический ток, так как валентные электроны могут свободно двигаться в кристаллической решетке.
В то же время эти подвижные электроны способствуют целостности кристалла, поскольку, где бы они ни двигались, они находятся одновременно около двух или более ядер.
В ковалентно построенных твердых веществах электроны строго локализованы в пространстве между отдельными парами атомов.
Для того чтобы эти вещества проводили электрический ток, большая часть энергии должна быть затрачена на вывод электронов из этой области между атомами.
В обычных электрических полях такой энергии нет, поэтому вещества с ковалентными связями, как правило, не проводят электрический ток.
Превосходная теплопроводность металлов также объясняется подвижностью электронов.
Электроны, которые находятся в областях высокой температуры, приобретают более высокую кинетическую энергию.
Электроны движутся через металл очень быстро и расходуют свою кинетическую энергию на нагревание кристаллической решетки в более холодных областях.
В тех веществах, где электроны строго локализованы, от атома к его непосредственному соседу передается лишь небольшое количество тепла.
Это более медленный процесс, чем электронная проводимость энергии.
Почему свойства металлов исчезают при переходе вдоль периода
В заключение нашего обсуждения образования металлических связей должны объяснить, почему свойства, присущие металлам, полностью исчезают при переходе вдоль периода к элементам, расположенным в правой части периодической таблицы.
Причины подвижности электронов в металлах состоят в том, что они легко удаляются из атома (низкая энергия ионизации).
И могут находиться близко к двум или более положительным ядрам в любой части кристалла (из-за наличия большого числа свободных валентных орбит).
При увеличении заряда атомных ядер и заполнении свободных орбит области между двумя ядрами постепенно становятся относительно более «привлекательными» для электрона по сравнению с другими частями пространства.
Электроны все больше стремятся локализоваться в этих областях, в результате чего появляются обычные ковалентные связи с их направленным характером.
Металлическая связь — это разновидность ненаправленной ковалентной связи.
Она возникает в том случае, когда атомы имеют мало валентных электронов по сравнению со свободными валентными орбитами и когда эти валентные электроны слабо удерживаются ядром.
Таблица испарения металлов
| Теплоты испарения металлов (ккал/моль) | |||
| Второй период | Li | Be | В |
| 32,2 | 53,5 | 129 | |
| Третий период | Na | Mg | Al |
| 23,1 | 31,5 | 67,9 | |
| Четвертый период | К | Ca | Sc |
| 18,9 | 36,6 | 73 | |
| Пятый период | Rb | Sr | Y |
| 18,1 | 33,6 | 94 | |
| Шестой период | Cs | Ba | La |
| 16,3 | 35,7 | 96 | |
Например, сравним теплоты испарения магния и алюминия.
Более высокое значение для алюминия показывает, что металлическая связь действительно становится более прочной при увеличении числа электронов и заряда ядра.
Таким образом:
Прочность металла возрастает при переходе от элемента к элементу вдоль периода периодической таблицы слева направо.
Кристаллические решетки переходных металлов являются более прочными, и эти металлы плавятся и кипят при более высоких температурах, чем щелочные и щелочно-земельны.
Металлическая связь примеры
Атомы после потери электрона становятся положительным ионом и, таким образом, взаимодействие между такими ионами и электронами приводит к когезионной силе связи, которая удерживает кристалл вместе.
В свободном состоянии металл не существует как один атом.
Он либо образует металлические связи с аналогичными атомами, либо образует ионную связь с любым неметаллом.
Не все металлы образуют металлические связи, находясь в свободном состоянии.
Ртуть, например, образует ковалентную связь металл-металл, которая существует в свободном состоянии и существует как Hg2+2.
В 1900-х годах Пол Друд выдвинул теорию о том, что металлические вещества существуют путем образования связей, которые имели “море электронов”, и это точное и принятое изображение в отношении металлических связей.
Эта структура иногда также описывается как “массив положительных ионов в море электронов”.
Металлическая связь описывается как совместное использование электронов на большой площади по сравнению с размером структуры.
И, следовательно, когда эти электроны разделяются, электричество также проводится.
Металлическая связь, присутствующая в металлах, является хорошим проводником электричества, поскольку электроны свободно текут и могут хорошо проводить электричество.
Кристалл металлического лития
Рассмотрим кристалл металлического лития. В его кристаллической решетке каждый атом окружен восемью ближайшими соседями.
Но поскольку этот атом имеет лишь один валентный электрон, он не может образовать обычные связи за счет электронных пар со всеми соседними атомами.
Однако атом лития имеет четыре свободные валентные орбиты, так что его электрон и электроны его соседей могут очень близко подойти к его ядру.
Таким образом, у каждого атома лития имеется избыток валентных орбит, но недостает электронов связи.
Рассмотрим, что представляет трудность для валентного электрона отдельного атома лития.
Он находится одновременно вблизи восьми ядер и имеет полную свободу движения по незанятым валентным орбитам вокруг собственного ядра.
Где бы электрон ни двигался, он находится между двумя положительными ядрами.
Все пространство вокруг центрального атома — это область с почти одинаково низкой потенциальной энергией.
В таких условиях электрон может легко передвигаться из одного места в другое.
Каждый валентный электрон действительно «свободен» в выборе пути движения в кристалле.
Литий представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки и погруженных в «море» подвижных электронов.
Такое представление о более или менее однородном электрон-море» подчеркивает важность различия между металлическими связями и простыми ковалентными связями.
В молекулярных ковалентных связях электроны локализованы таким образом, что положения атомов строго определенны.
Мы говорим, что связи имеют направленный характер: электроны стремятся сосредоточиться в определенных областях пространства.
Наоборот, валентные электроны в металле распределены почти равномерно по всему кристаллу, так что металлическая связь не имеет направленного характера обычной ковалентной связи.
Мы можем получить некоторое представление об эффективности этого электронного «моря» в образовании связей между атомами.
Для этого сравним энергию, необходимую для испарения 1 моля металла до свободных атомов, с энергией, которая требуется для разрушения 1 моля вещества с обычными ковалентными связями.
Мы нашли, что энергия, необходимая для испарения 1 моля щелочного металла, в 3—4 раза меньше энергии, необходимой для разрушения 1 моля вещества с обычными ковалентными связями.
Энергия ионизации свободного атома щелочного металла мала; это значит, что валентный электрон в свободном атоме не испытывает сильного притяжения к ядру.
Поскольку электрон слабо притягивается одним атомом щелочного металла, он так же слабо притягивается и двумя, и тремя такими атомами в кристалле.
Таким образом, энергия связей между электронами и ядрами в кристаллах щелочного металла довольно мала, в результате чего образуются относительно слабые металлические связи.
Однако мы можем ожидать, что металлическая связь будет гораздо сильнее в тех элементах, которые имеют большее число валентных электронов и более высокий заряд ядра.
В этих случаях в электронном (море) находится больше электронов и каждый электрон связан более прочно благодаря увеличенному заряду ядра.
Это рассуждение находится в соответствии с экспериментальными значениями теплоты испарения, приведенными в таблице.
Объемные свойства металлов
Металлы имеют несколько свойств, которыми они известны.
Некоторые из них-проводимость, ковкость, пластичность, блеск, высокая температура плавления и высокая температура кипения.
Металлы существуют в виде твердой структуры, но их можно легко деформировать.
Свойства металлов в свободном состоянии обусловлены расположением электронов в металлической связи.
Поскольку валентные электроны свободны, делокализованы, подвижны и не связаны с каким-либо конкретным атомом, можно объяснить несколько свойств металлов.
Проводимость
В металлических связях электроны могут свободно перемещаться в пределах кристаллов, в которых они существуют.
Это позволяет легко перемещать электрический заряд. Если электроны от любой внешней силы толкаются в металл из-за электрической цепи.
Электроны могут перемещаться через электронное море и выходить с другого конца металла, подключенного к электрической цепи.
Ковкость и пластичность
Если к металлу приложена внешняя сила, море электронов действует как подушка для этой силы.
Таким образом, структура металлов не повреждается и не изменяется, протоны только перестраиваются в соответствии с приложенной силой.
Море электронов перестраивается, чтобы приспособиться к новому расположению протонов и, таким образом, сохранить металл нетронутым.
Кристаллическая структура не разрушается, они только деформируются из — за внешней силы. Это причина ковкости и пластичности металлов.
Теплоемкость
Металлы могут проводить тепло, расширяться и сжиматься при нагревании или охлаждении, что позволяет использовать их различными способами.
Эта теплоемкость и тепловое расширение также связаны с тем, что свободные электроны могут перемещаться по твердому телу, облегчая проводимость тепла и расширение, когда электроны энергично движутся.
Блеск
Свободные электроны в море электронов могут свободно поглощать фотоны, и поэтому металлы выглядят непрозрачными.
Электроны на поверхности металла могут отражать свет с той же частотой, с которой свет попадает на его поверхность, и поэтому металлы кажутся блестящими.
Металлическая связь в расплавленном металле
В расплавленном металле, хотя металлическая связь все еще присутствует, упорядоченная структура разрушается.
Но металлическая связь, которая существует в твердой форме металла, не полностью разрушается, пока металл не закипит.
Металлическая связь полностью разрушается, когда металл кипит, но она лишь слегка ослабляется, когда плавится.
Прочность металлических связей
Прочность любой металлической связи зависит от трех факторов:
- Количество электронов, которые делокализуются из металла
- Заряд металлического иона
- Размер металлического иона
Металлические связи очень прочны и требуют большого количества энергии для разрыва, и, следовательно, они имеют высокую температуру плавления и высокую температуру кипения.
Сильная металлическая связь подразумевает большее количество делокализованных электронов, что приводит к увеличению эффективного заряда на катионе, что делает размер катиона меньше.
Растворимость и образование соединений металлов
Если они не вступают в реакцию с ними, металлы не растворяются в воде или любые органические растворители.
Реакция, которая делает металл растворимым, обычно представляет собой реакцию окисления, которая лишает атомы металла их странствующих электронов, тем самым разрушая металлическую связь.
Тем не менее, металлы легко растворимы друг в друге, и они сохраняют металлические характеристики своего соединения.
Например, золото легко растворяется в ртути даже при комнатной температуре.
Иногда они сохраняют свои первоначальные свойства, но иногда слияние двух металлов образует металлическое соединение с совершенно другой структурой.
Мы называем их сплавами. Область исследований, касающаяся плавления металлов в сплавы, называется металлургией.
Оптические свойства
Море носителей заряда, то есть электронов, оказывает глубокое влияние на оптические свойства металлов.
Мы можем понять это, только если рассмотрим электроны как коллектив, а не отдельные электроны.
Мы все знаем, что свет представляет собой комбинацию электрического и магнитного поля.
Электрическое поле света обычно способно возбуждать упругий отклик от электронов, которые существуют в металлическом кристалле.
Таким образом, фотоны не могут проникнуть глубоко в металл и обычно отражаются, в то время как некоторые могут быть поглощены. Этой характеристикой обладают все фотоны видимого спектра.
Именно по этой причине металлы часто бывают серебристо-белого или серовато-белого цвета. Баланс между поглощением и отражением света определяет, насколько они серые или белые.
Серебро, например, является металлом с высокой проводимостью, а также одним из самых белых по цвету.
Заметными исключениями из этого являются красноватая медь и желтое золото. Это связано с существованием верхнего предела частоты, на которую могут реагировать металлические электроны.
Металлическая связь вопросы, ответы?
Примеры?
Простые вещества с металлической связью — металлы (Na, Ba, Al, Cu, Au и др.), сложные вещества — интерметаллические соединения (AlCr₂, Ca₂Cu, Cu₅Zn₈ и др.).
Что обобществляется при образовании?
Имеет сходство и с ковалентной связью. Это сходство основано на обобществлении электронов, но при образовании ковалентной связи обобществляются внешние неспаренные электроны двух соседних атомов, а при образовании металлической в обобществлении участвуют все атомы.
Каковы свойства?
Это сила, которая удерживается вместе внутри металлических элементов. Наличие металлических связей приводит к их свойствам.
Прочность, ковкость, пластичность, тепловая и электрическая проводимость, непрозрачность и блеск являются ее свойствами.
Ковкость это свойство металла, которое может быть сформировано в любую форму без разрушения. Пластичность-это свойство металла деформироваться при растяжении.
Тепловая и электрическая проводимость означает способность металла пропускать тепло или ток через него.
Блеск означает, что металлические связи будут сиять, если какой-либо свет отражается через них. А непрозрачность означает, что она не пропускает свет.
Почему металлические связи сильны?
Из-за присутствующих в элементах, атомы плотно удерживаются вместе. Структура металлов в основном компактна, а атомы расположены в регулярном порядке.
Электроны из внешних оболочек атома делокализуются. Это означает, что они могут свободно перемещаться в любом месте вокруг структуры. И это разделение локализованных электронов между атомами приводит к сильной металлической связи.
Металлические металлы имеют высокую силу притяжения между атомами, и для ее преодоления требуется много энергии.
Как атомы связываются в металлической связи?
Атомы удерживаются вместе силой. Она возникает, когда есть доля валентных электронов.
Например, если натрий металлически связан с самим собой, третья оболочка до восьмой орбиты является общей друг с другом. И то же самое происходит с любым другим элементом, связывающимся с самим собой.
В основном, когда заряд распределяется на большее расстояние по сравнению с размером атомов, присутствующих в структуре, образуются металлические связи.
Согласно периодической таблице позиционирования, элементы, присутствующие на левой стороне образуют металлические связи.
В чем разница между металлической связью и ионной связью?
Металлическая связь образуется, когда происходит совместное использование электронов по площади. тогда как ионная связь образуется при переносе электронов между двумя химическими веществами.
Ионная связь происходит между положительными и отрицательными ионами, а металлическая связь происходит между положительными ионами и электронами.
Часто задаваемые вопросы
Заключается в притяжении положительных ионов металлов и обобществлённых электронов.
Эти связи, характерны для металлов и их сплавов, при котором валентные электроны свободно перемещаются через весь кристалл, образуя «электронный газ».

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.