Ковалентная связь, как основа формирования молекул, играет ключевую роль в химии и биохимии. Она не только объясняет существование таких простых молекул, как Н2 и Cl2, но и лежит в основе более сложных соединений, включая органические соединения, жизненно важные для существования организмов.
Образуется благодаря взаимодействию электронов с противоположными спинами, что приводит к образованию устойчивых электронных облаков.
Это обобществление электронов, обеспечивающее атомам стабильность, объясняет множество химических явлений, наблюдаемых в природе.
Вместе с тем, необходимо учитывать и полярность ковалентной связи, которая влияет на свойства молекул и их реакционную способность.
Понимание этой связи позволяет предсказывать поведение различных соединений в химических реакциях, что имеет большое значение в научных и практических исследованиях.
Что такое ковалентная связь
Существование таких молекул, как Н2, O2 и Сl2, невозможно объяснить с помощью представления об ионной связи.
В 1916 г. американский химик Джильберт Ньютон Льюис предположил, что химическая связь между одинаковыми или близкими по свойствам атомами осуществляется с помощью одной или нескольких пар электронов, принадлежащих в равной степени каждому из атомов.
Такое «обобществление» электронных пар позволяет атомам окружить себя устойчивой электронной оболочкой инертного элемента и приводит к выигрышу в энергии.
Образование молекул Н2 и Сl2 выражается, с точки зрения теории Льюиса, следующей схемой:
Новая теория смогла объяснить строение большинства органических и неорганических соединений.
Однако она не отвечала на принципиально важный вопрос: почему электронная пара обладает связующим действием?
Кроме того, вскоре обнаружилось множество отклонений от правила октета.
Рассмотрим, ковалентной связи на примере, электронное окружение атомов углерода, фосфора и серы в молекулах CF4; PF5; SF6: смотрим (рис. выше)
Из приведённых схем ясно видно, что на внешнем энергетическом уровне атомов фосфора и серы находится соответственно десять и двенадцать электронов.
Это нарушает стройность теории Льюиса и заставляет подойти к проблеме возникновения химической связи с точки зрения законов микромира.
Квантовомеханическое рассмотрение ковалентной связи
Рис. 3. Взаимодействие s-электронных облаков двух атомов водорода:
а — спины электронов антипараллельны; б — спины электронов параллельны.
Согласно квантовомеханическим расчетам, проведенным немецкими физиками Вальтером Гайтлером и Фритцем Лондоном, два атома водорода могут соединиться и образовать молекулу только в том случае, если их электроны имеют противоположные спиновые квантовые числа для одного электрона.
Например:
ms= — 1/2,
а для другого:
— +1/2.
В противном случае атомы водорода отталкиваются.
Отсюда легко сделать общий вывод: ковалентная связь появляется в результате взаимодействия электронов с противоположными (антипараллельными) спинами.
Она может возникнуть как между атомами одного и того же элемента (Сl2, O2), так и между различными атомами (НСl; ClF).
Образования ковалентной связи
Необходимым условием образования ковалентной связи является наличие у каждого из взаимодействующих атомов одного или нескольких не спаренных электронов.
Раз так, должны существовать молекулы Li2; Na2 и К2. ведь атомы щелочных металлов подобно водороду имеют на наружном энергетическом уровне один не спаренный электрон.
Такие молекулы действительно присутствуют в парах щелочных металлов.
Поскольку электроны обладают одновременно волновыми и корпускулярными свойствами и при своем движении в атоме образуют различные по форме электронные облака.
Возникновение ковалентной связи можно приближенно представить как результат перекрывания соответствующих электронных облаков.
Например, ковалентная связь образуется между атомами водорода с противоположными спинами электронов происходит перекрывание сферически симметричных s— электронных облаков.
Приводящее к возрастанию плотности отрицательного заряда в пространстве между ядрами (рис. 3, а).
Общая энергия системы (Н + Н) при этом понижается, что приводит к возникновению прочной ковалентной связи.
Если спины электронов параллельны, то электронные облака отталкиваются и молекула Н2 не образуется (рис. 3, б).
Электронное облако, осуществляющее химическую связь между одинаковыми атомами, является симметричным; оно принадлежит в равной степени обоим атомам.
Электронное облако, связывающее два различных атома, смещено в сторону более электроотрицательного компонента.
Например, в молекуле НСl электронное облако связи смещено в сторону атома хлора, в молекуле воды — в сторону атомов кислорода и так далее.
Таким образом, оказывается, что ковалентная связь в большинстве случаев полярна, а ионную связь можно рассматривать как крайний (предельный) случай ковалентной связи.
Переход от чисто ионной связи к неполярной ковалентной происходит постепенно.
Чем дальше отстоят элементы друг от друга на шкале электроотрицательности, тем более ионной является связь между ними.
Ковалентная связь в молекуле водорода
При нормальных условиях температуры и давления водород представляет собой газ.
Взвесив измеренный объем газообразного водорода и применив закон Авогадро, можно убедиться, что молекула водорода состоит из двух атомов водорода.
Лишь при увеличении температуры до нескольких тысяч градусов молекулы водорода приобретают такую энергию, что в результате их столкновения друг с другом могут образоваться атомы.
Например:
Н2(г) ⇄ Н(г) + Н(г)
∆Н = 10,4 ккал (1)
Поскольку в реакции (1) поглощается энергия, молекула Н2 более устойчива (имеет более низкую энергию), чем два отдельных атома.
Эта химическая связь (и любая химическая связь) образуется за счет того, что энергия системы будет ниже, если атомы располагаются близко друг к другу.
Причина устойчивости химической связи в молекуле водорода
Для того чтобы понять, почему энергия уменьшается, если атомы находятся близко друг к другу, мы должны рассмотреть взаимодействие между электрическими зарядами в атоме.
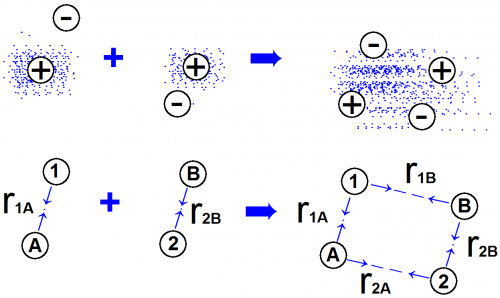
На рис. 4 схематически изображена реакция, обратная реакции (1). Из квантовой механики известно, что 1s-орбита каждого атома водорода до реакции имеет сферическую симметрию.
Это отображено на рис. 4. Однако на мгновение мы зафиксировали электрон в некоторой данной точке, изобразив его отрицательный заряд 1 — на расстоянии r1A от ядра А.
Энергию атома водорода А можно представить средним значением энергии притяжения между электроном 1 и ядром А.
Результат того притяжения — расположение электрона и ядра при среднем расстоянии между ними r1A.
То же самое справедливо и для атома водорода В — электрон 2 и ядро В притягиваются друг к другу.
Пример связи в молекуле водорода
Рассмотрим новое электрическое взаимодействие, возникающее после того, как атомы приблизились друг другу. Теперь электрон 1 притягивается обоими протонами.
Электрон 2 тоже притягивается обоими протонами. Это и является «клеем», который удерживает два атома вместе.
Химическая связь в Н2 образуется вследствие того, что каждый из двух электронов притягивается двумя протонами одновременно.
Такая группировка энергетически более устойчива, чем отдельные атомы, в которых каждый электрон притягивается только одним протоном.
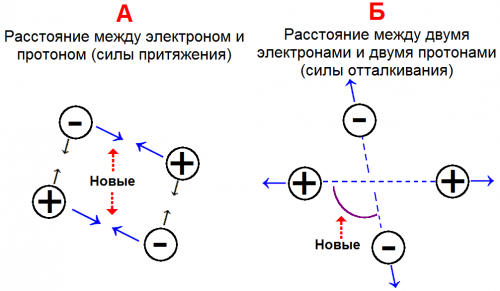
На рис. 1-15, А показано возможное расположение электронов и протонов, которое можно было бы видеть на моментальном снимке.
На таком расстоянии между ними возникает притяжение, в результате которого образуется химическая связь.
Но необходимо помнить о том, что при сближении двух атомов происходит и отталкивание, как показано на рис. 1-15, Б. Два электрона отталкивают друг друга; то же наблюдается и для двух протонов.
В результате этого два атома удаляются друг от друга. Какое же из взаимодействий более важно — две новые силы притяжения или две новые силы отталкивания (рис. 1-15)?
Опыты показывают, что преобладает притяжение — образуется устойчивая химическая связь Однако нельзя сказать, что отталкивание неощутимо.
Действительно, протон-протонное отталкивание препятствует слишком тесному сближению двух атомов водорода.
Стандартная длина связи (равновесное межатомное расстояние) в молекуле водорода определяется равновесием между силами притяжения (рис. 1-15, А) и силами отталкивания (рис. 1-15, Б).
Как мы видим на рис. 1-15, при соединении двух атомов водорода возникают две новые силы отталкивания и две новые силы притяжения.
Опыты показывают, что образуется химическая связь; энергия притяжения преобладает над энергией отталкивания. Почему это так? Объяснение заключается в подвижности электронов.
Электроны не занимают фиксированных положений, а движутся по всей молекуле.
Благодаря такой подвижности электроны могут оставаться на большом расстоянии друг от друга.
Они преимущественно занимают положения, подобные показанным на рис. 4: каждый электрон находится ближе к обоим ядрам, чем к другому электрону.
Два электрона с успехом «избегают» положений, в которых они находились бы близко друг к другу.
Поэтому говорят, что они «коррелируют» свое движение так, чтобы оказаться на максимальном расстоянии друг от друга, вследствие чего уменьшается электрон-электронное отталкивание.
Статья на тему Ковалентная связь


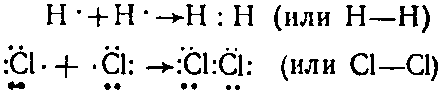

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.