Почему вода источник жизни
Испаряясь и утончаясь, она производит воздух, сгущаясь — твердые тела. Действительно, прекрасные кристаллы горного хрусталя напоминают лед и могут дать повод уму, не искушенному в эксперименте, предположить, что это окаменевший лед…
Времена Фалеса давно миновали, никто уже не думает, что основой мира является вода, о интуиция ученого философа заслуживает уважения: он был прав потому, что роль маленькой молекулы воды в жизни природы действительно необычайно важна.
Рис. Вода источник жизни
Колыбелью жизни на нашей планете был океан; весь ход биологической эволюции и процессы жизнедеятельности тесно связаны с превращениями, идущими в водной среде. Удаление воды означает или гибель, или прекращение процессов обмена. Известно, что высушенные семена растений могут сохраняться тысячелетиями, не проявляют признаков жизни, но если их смочить, огонек жизни делается заметным — начинается прорастание.
Попытаемся выяснить, что представляет собой молекула воды и почему она играет столь важную роль в биологических процессах. Сравнение свойств гидридов элементов VI группы таблицы Д. И. Менделеева показывает, что вода — гидрид кислорода и в обычных условиях должен бы быть газом. Действительно, температуры кипения гидридов элементов VI группы понижаются по мере уменьшения массы атома элемента и относительно высокая температура кипения воды кажется неожиданной— аномальной (табл.1).
Та блица 1 Температура кипения гидридов элементов VI группы
| Элементы | Гидриды | Температура кипении в ° С |
| Кислород | Н2О | + 100 |
| Сера | H2S | —60 |
| Селен | Н2Se | —41 |
| Теллур | Н2Те | —2 |
Опыт показывает, что вода ведет себя непредвиденным образом и в других отношениях: у нее оказывается очень большая теплота испарения, теплоемкость, водяной пар при быстром расширении конденсируется, вместо того чтобы переходить в состояние ненасыщенного пара; плотность воды уменьшается от 0 до +4° С, а затем снова растет; затвердевая, вода расширяется, тогда как большинство других веществ при этом сжимаются, и т. д. Вода резко ослабляет силу взаимодействия электрических зарядов; если заряженные тела перенести из воздушной среды (или вакуума) в воду, то сила взаимодействия падает в 81 раз. Это значит, что у воды аномально большая диэлектрическая проницаемость. Лишь очень немногие вещества имеют аналогичные свойства. Так, синильная кислота обладает диэлектрической проницаемостью, равной 107, огромное большинство жидких сред характеризуется меньшими значениями этого свойства.
Благодаря большому значению диэлектрической проницаемости вода поддерживает растворенные в ней соли, кислоты и основания в ионизированном состоянии. Быстро протекающие химические реакции чаще всего совершаются между ионами, т. е. заряженными частицами. Ионы регулируют действие множества биологических катализаторов — ферментов, без которых невозможна жизнь; движение ионов через биологические мембраны обусловливает передачу нервного возбуждения, концентрация ионов в почве определяет возможность нормального роста растений и т. д. Полому для развития жизни совершенно необходима среда, поддерживающая надлежащий уровень, ионизации молекул.
Высокая диэлектрическая проницаемость и большие значения теплот испарения могут быть истолкованы с единой точки зрения — обе аномали говорят об одном и том же.
Действительно, диэлектрическая проницаемость, равная 81, указывает на то, что молекула воды заметно поляризована. Вследствие особенностей строения молекулы центры тяжести ее положительных и отрицательных зарядов не совпадают и молекула ведет себя как стержень, имеющий па одном конце положительный, а на другом отрицательный заряд — диполь. Диполи притягиваются друг к другу, и, для того чтобы разделил, их и удалить на значительное расстояние, необходимо совершить работу, и тем большую, чем больше сила взаимодействия между диполями. Отсюда делается вывод, что вода, молекулы которой являются диполями, должна при испарении поглощать большое количество энергии и, следовательно, вполне может быть жидкостью при тех условиях, при которых аналогичные соединения, но не столь сильно поляризованные, уже находятся в газообразном состоянии.
Молекулы сероводорода, в частности, имеют вдвое меньший дипольный момент и больший объем; сила притяжения между ними слабее, и сероводород является в обычных условиях газом.
При понижении температуры полярные молекулы воды образуют кристаллическую решетку льда; конечно, и в этом случае проявляются силы сцепления, они и обусловливают большую величину теплоты плавления льда.
Можно попробовать объяснить с этой точки зрения и другие аномалии воды. Одной из таких аномалий является способность водяного пара конденсироваться при понижении давления. Мы настолько свыклись с тем, что падение давления есть признак плохой погоды — дождя или тумана, что не обращаем внимание на аномальность этого факта. Ведь из курса физики известно, что понижение давления переводит насыщенный пар в состояние ненасыщенного, и, следовательно, нет оснований ожидать, что падение давления вызовет конденсацию и образование капель жидкости. А у воды именно это и происходит — из пара образуются капли жидкой воды. Причина аномалии в том, что падение давления вызывает расширение водяного пара, а расширение приводит к увеличению средних расстояний между молекулами воды. Энергия, нужная для этого при быстром протекании процесса, черпается из запасов внутренней энергии водяного пара; в результате температура пара снижается и начинается конденсация. Еще одна аномалия оказывается обусловленной большими силами межмолекулярного сцепления или, иными словами, оказывается связанной с асимметричной структурой молекулы воды.
В чем же заключается эта асимметрия? Как построена молекула воды? Молекула воды согнута. Линии, соединяющие центры атома кислорода с центрами атомов водорода, образуют угол 104,28°. Каждая из связей О — Н полярна, т. е. представляет собой диполь; если бы эти диполи были расположены на одной прямой, то они полностью компенсировали бы другие и общий дипольный момент молекулы был бы равен нулю. Расчет показывает, что более устойчивым является положение, в котором линии центров групп ОН образуют между собой угол в 90°, влияние внутренних электронов атома кислорода, как предполагают, приводит к тому, что наиболее энергетически выгодным оказывается расположение, отвечающее углу в 104,28°. Природа «согнула» молекулу воды, и этим в значительной мере определилась ее удивительная роль в эволюции поверхности нашей планеты и в развитии форм жизни на ней.
Распределение электронной плотности р— электронов атома кислорода. Кроме того, имеются еще два электрона, расположенные так, что распределение их заряда имеет сферическую симметрию (электроны s-типа).
Атом водорода имеет s-электрон, плотность заряда которого распределена сферически. Для образования связи важно, чтобы электронные облака атомов кислорода и водорода перекрылись, т. е. их электроны стали бы общими. Перекрытие и происходит между облаками р— электронов кислорода и sоблаками атомов водорода. На образование связи нужно два электрона: по одному от каждого атома; пара электронов и образует общее зарядовое облако.
После образования связей у кислорода остается два электрона р-типа и два s-типа, которые не были использованы для связей. Электроны s-типа, по-видимому, влияют на угол между линиями центров Н — О, обусловливая, как было сказано выше, отклонение угла от 90°.
Дипольный момент молекулы воды возникает по двум причинам: во-первых, каждая из связей О — Н полярна и на том конце, где находится ядро водорода, имеется избыток положительного заряда, а на «кислородном» конце избыток отрицательного, а во-вторых, пары электронов, не использованные для связей, создают дополнительную плотность отрицательного заряда на атоме кислорода.
Этот вклад в дипольный момент оказывается даже более существенным, чем вклад от полярности связей.
Для качественного описания структуры молекулы воды (по Слэтеру) можно представить себе картину тетраэдрического расположения связей. Две связи направлены от центра тетраэдра, в котором находится атом кислорода, к углам, где помещаются атомы водорода; по этим направлениям приблизительно и ориентированы оси связывающих электронных облаков. Пары электронов, не участвующих в связях, находятся на орбиталях, оси которых направлены также к углам тетраэдра; эти электронные пары обусловливают электростатическое притяжение между данной молекулой воды и атомами водорода соседних молекул. В результате в жидкой воде и в кристаллах льда проявляется тенденция к тому, чтобы каждый атом кислорода был тетраэдрически окружен четырьмя атомами водорода, причем два из них (принадлежащие данной молекуле воды) расположены ближе к атому кислорода, а два других (принадлежащие соседним молекулам) размещены на большем расстоянии. Тетраэдр, таким образом, не вполне правильный.
Связи между различными молекулами воды, как видно, осуществляются за счет прогона, оказавшегося между двумя электронными парами: О: Н -:О, т. е., как мы уже говорили, за счет водородных связей.
Диполи воды очень деятельные частицы. Их малый размер и большая напряженность электрического поля позволяют им активно вмешиваться и разнообразные реакции.
Когда, например, в водной среде оказывается кристалл соли (например, хлорида натрия), то диполи воды немедленно притягиваются к ионам, находящимся на поверхности кристалла; энергия взаимодействия иона и диполей воды настолько велика, что ионы покидают свои места в кристаллической решетке и уходят в водную среду, окруженные оболочками из молекул воды. Велики ли эти водяные «шубы»? У различных ионов они неодинаковы. Чем меньше размер иона и больше его заряд, тем прочнее удерживаются диполи воды и гидратной оболочке — шубе иона, вполне прочно удерживаются лишь 4—6 молекул поды.
Способность диполей поды образовывать различные структуры создавать разнообразные и сложные конструкции — отчетливо проявляется в формировании разновидностей льда, отличающихся по плотности. Известно шесть разновидностей льда. Они могут находиться в равновесии с обычным льдом или друг с другом лишь при очень высоких давлениях (порядка нескольких тысяч атмосфер).
Как же ведут себя большие массы поляризованных молекул воды в жидкой фазе?
Па первый взгляд, ответ па лог вопрос очевиден. Ведь молекулы движутся, и притом хаотически, о каком же регулярном расположении вообще идет речь? Однако данные, полученные в результате рентгенографического анализа, говорят о другом: в воде имеются явные признаки упорядоченной структуры. Предположим, что на мгновение прекратились все движения молекул воды, и допустим, что мы в состоянии видеть каждую молекулу; тогда, взглянув на воду, мы обнаружим существование ближнего порядка. Это значит, что в непосредственной близости от данной молекулы воды другие молекулы расположены по определенному закону. Особенность, характеризующая жидкость, заключается в том, что порядок не строго выдерживается и во времени й в пространстве. Если отодвинуться подальше от избранной молекулы, то мы попадаем в область, где порядок уже нарушен; если подождать некоторое время, то окажется, что и ближайшие молекулы обмениваются местами. В воде нет хаоса, но порядок постоянно нарушается и вновь восстанавливается. Огромные силы внутреннего давления, сжимающие воду, ограничивают возможности быстрых перемещений — одна молекула «топчется» около другой, пока ей удастся покинуть свое место и сделать более или менее значительный скачок в сторону. Правда, продолжительность «топтания» велика лишь по молекулярным масштабам: она составляет около 10-10 сек. Но ведь период молекулярных колебаний равен 10-13 сек, и 10-10 сек — это для молекулы уже «долго».
Главное в результатах изучения внутренней структуры воды и льда заключается в том, что эти структуры очень похожи друг на друга. Характерное для льда общее расположение молекул не исчезает при плавлении, при этом происходят только местные нарушения строгого порядка. Жидкая вода оказывается гораздо более похожей на лед, чем это может показаться при первом знакомстве с этими двумя состояниями воды.
Характерной чертой структуры льда является то, что каждая молекула воды окружена четырьмя соседними. В этой кристаллической решетке имеются полости-пустоты. В жидкой воде, охлажденной до температуры, близкой к нулю, также существует подобие правильного расположения молекул, но уже с некоторыми нарушениями порядка, или, как говорят, с дефектами: то молекула попадает в полость, то обнаруживается недостача молекулы в окружении этой полости и т. д. Порядок сохраняется лишь в малых микрокристаллических областях, размер которых имеет порядок 1,0 нм (рис. 2).
Беспорядочное расположение молекул воды отвечает большей плотности, чем упорядоченное, поэтому при плавлении льда наблюдается сжатие, а замерзание жидкой воды, наоборот, сопровождается расширением. Существуют условия, в которых жидкая вода делается особенно похожей на лед. Так, тонкие слои воды, зажатые между двумя пластинками из слюды, проявляют свойства, характерные не для жидкой воды, а для льда.
Опытные данные, относящиеся к состоянию воды на поверхности различных других твердых тел, также свидетельствуют в пользу гипотезы, что вода в этих условиях структурно упорядочена, т. е. имеет сходство со льдом.
Стремление молекул воды как-то «организовываться», образуя разнообразные структуры, находит своеобразное выражение во взаимодействиях между водой и органическими веществами.
Молекулы воды могут ориентироваться около молекулы метана так, что получается непрочный гидрат этого газа. Грозди молекул воды около молекулы метана получили название айсбергов— состояние воды в них имеет сходство с состоянием воды в кристаллах льда. Образование айсбергов наблюдалось и в других случаях с более сложными молекулами. Различные газы: этан, этилен, хлор, оксид серы (IV) и даже инертные газы (аргон, криптон) образуют с водой гидраты, причем количество теплоты, выделяющееся при этом в расчете на моль газа, почти не зависит от его химической природы. Это выглядит несколько странно — казалось бы, если речь идет о химическом процессе, его энергетический эффект должен прежде всего зависеть от химической характеристики соединяющихся молекул. Фактически на моль газа выделяется во всех указанных случаях около 60 кдж/моль. Загадка разгадывается неожиданно просто. Молекулы газов попадают в пустоты, имеющиеся между молекулами воды; молекулы, застрявшие в этих пустотах, стабилизируют окружающие группы молекул воды. И сущности, именно молекулы газов и сохраняют эти тонкие и хрупкие сетки, сплетенные из частиц воды. Предполагают, что в гидратах молекулы воды расположены по углам пятиугольников, а из пятиугольников строятся сложные многогранники (полиэдры), пустоты в которых и заполнены молекулами газов. Если удалить газы, то устойчивость всего каркаса уменьшается и он подвергается частичному или полному распаду и перестройке. Некоторые авторы (И. Клотц) считают, что, окружая углеводородные группы, входящие в состав белков, вода стабилизирует молекулы белка и, следовательно, те формы, в которых белковые молекулы находятся и функционируют в организмах, в значительной степени связаны с влиянием молекул воды.
Вода источник жизни и в растительных тканях не представляет собой хаотизированной среды; молекулы ее расположены относительно упорядоченно, и можно сказать, что вода в нашем организме имеет определенное сходство со льдом. Этот удивительный вывод был использован Л. Полингом в его теории наркоза. Л. Полинг предположил, что функции некоторых наркотизирующих веществ заключаются в том, что они облегчают образование вокруг молекул белков структурированной воды, повышая ее устойчивость за счет образования гидратов. Хорошим подтверждением мысли Л. Полинга является тот факт, что наркотический эффект может быть достигнут просто охлаждением мозга, когда структурирование воды вызывается понижением температуры и ослаблением тепловых движений молекул воды. Повышение давления частично разрушает гидраты и действительно снимает эффект наркоза. Причина, по которой образование гидратных структур, т. е. скоплений молекул воды (айсбергов), приводит к ослаблению нервной активности мозга (наркозу), по мнению И. Клотца, заключается в том, что при этом возникают коротко замкнутые цепи в нервных клетках. Возникновение коротких замыканий, затрудняющих передачу импульсов, есть следствие увеличения подвижности ионов водорода в микрокристаллах. Хотя теория наркоза и может еще вызывать споры, но необычайные свойства ионов водорода никаких сомнений не вызывают и заслуживают рассмотрения.
Вода — плохой электролит, т. е. лишь небольшая доля молекул воды, находящихся в данном объеме, подвергается электролитической диссоциации на ионы Н+ и ОН—. В литре чистой воды содержится при комнатной температуре всего 10-7 г ионов Н+ и 17•10-7 г ионов ОН—. Лед еще менее диссоциирован; в 1 л замерзшей воды остается только 10-10 г ионов Н+ — тысячная доля от того количества, которое было в жидкой воде. Но поразительно, что столь резкое уменьшение концентрации ионов Н+ очень слабо отражается на электропроводности, электропроводность льда лишь в три раза меньше, чем у воды (по эквивалентной проводимости), в три, а не в тысячу! В то же время электрические заряды переносят именно ионы Н+ и ОН—, и следовало бы ожидать, что уменьшение их числа существенно скажется на способности проводить ток.
Есть еще один фактор, что вода источник жизни от которого зависит электропроводность,— это подвижность ионов; мерой подвижности служит скорость движения иона в поле с падением потенциала 1 в/см. Подвижность связана с природой иона, и уже в жидких средах, как было доказано прямым опытом, ион водорода оказывается самым быстрым. В кристаллической решетке льда подвижность иона водорода, очевидно, возрастает и делается в сотни и тысячи раз большей, чем в воде. Подвижность ионов гидроксила во льду также больше, чем в воде. Чтобы понять, в чем дело, надо выяснить механизм переноса тока в средах, содержащих ионы Н+.
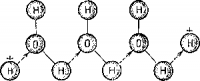
Характерной особенностью движения ионов водорода является цепной, или эстафетный, механизм. Ион водорода приближается к молекуле воды (рис. 11), возникает водородная связь. Затем эта связь переходит в обычную химическую (ковалентную), а ион водорода, ранее входивший в состав молекулы воды, отщепляется. Он присоединяется к следующей молекуле, от которой также одновременно отделится ион водорода, и процесс будет продолжаться, развиваясь по цепи молекул воды. Можно сказать, что результатом приближения иона водорода к одному концу цепи молекул воды было отщепление попа водорода от другого конца цепи. Быстрота, с которой совершился весь этот процесс, зависит не от скорости движения иона, а от скорости обмена ионами водорода между молекулами воды. В кристалле льда обмен идет легко, так как молекулы льда менее подвижны и, кроме того, весь кристалл льда в целом представляет собой упорядоченную структуру; в жидкой воде, как мы уже знаем, наряду с упорядоченными областями встречаются и хаотизированные. Итак, во льду, оказывается, двигаться легче, чем в воде; на самом деле, лед ускоряет многие реакции, которые требуют участия ионов водорода, лед настоящий катализатор. Похожие па лед айсберги существуют и в организмах. В них, следовательно, тоже легче протекают различные реакции.
Несомненно, что увеличение подвижности ионов Н+ (а также атомов Н и даже гидридных ионов Н—) может быть следствием структурирования воды, а так как перенос ионов играет важнейшую роль в действии ферментов и функциях белковых структур (мембран различного типа), то все факторы, влияющие на способность молекул волы группироваться в микрокристаллы, отражаются и па состоянии клеток и систем клеток. Поэтому вода не является просто средой, это (по Сцент-Дьерди) неотъемлемая часть живой машины.
Можно ли считать, что вода и в самом деле какое-то аномальное вещество и что ее необычными свойствами обусловлены особенности известных нам форм жизни?
Внимательный анализ показывает, что это не так. Свойства воды в сущности не неожиданны, это вполне закономерный переход количественных факторов в качественные. Размеры молекул гидридов теллура, селена, серы и кислорода уменьшаются от теллура к кислороду, дипольный момент растет, напряженность электрического поля около молекулы увеличивается. Вместе с тем уменьшается число электронов, окружающих атом неметалла, отталкивание электронных оболочек соседних молекул. Все это благоприятствует проявлению сил притяжения между молекулами и, следовательно, образованию прочных ассоциаций (скоплений) частиц.
Поляризация молекул и действие диполей наблюдается у большого числа веществ; так, например, органические соединения, содержащие группы ОН, СООН, NH2 и т. п., в той или иной мере ассоциированы, т. е. их молекулы, как и молекулы воды, образуют неустойчивые группы за счет водородных связей и эти вещества в жидком состоянии также обладают некоторыми признаками кристаллической структуры. Вода в этом отношении не уникальна, однако ее свойства имеют такое количественное выражение, которое делает именно воду незаменимым компонентом в биологических структурах.
Индивидуальность воды, по существу, есть отражение своеобразия свойств кислорода.
Вообще свойства соединений элементов, расположенных на «вершинах» подгрупп периодической системы (водород, бериллий, бор, углерод, азот, кислород, фтор), более или менее резко отличаются от среднего уровня, который характерен для элементов данной подгруппы в целом. Причиной этого является малый радиус и небольшое число электронных слоев, отличающих легкие элементы от их родственников по подгруппе.
Поэтому удивление заслуживают не столько особенности воды, сколько законы, в силу которых изменения в электронном строении молекулы могут приводить к поразительным качественным эффектам.
Несомненно, вода, биологическое значение которой так велико, откроет еще не одну тайну вдумчивому исследователю.
Статья на тему Вода источник жизни


Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.