Теория
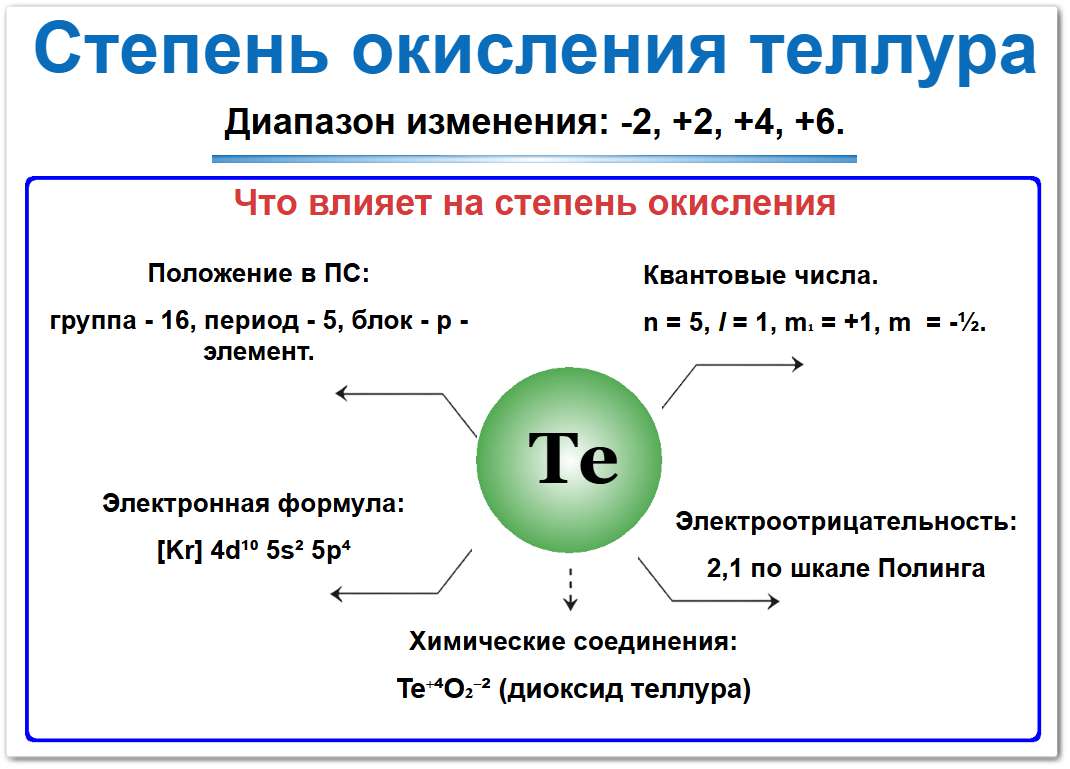
Теллур (Te) — химический элемент 16‑й группы (халькогены), располагающийся в 5‑м периоде под селеном.
По положению в таблице Менделеева он является типичным полуметаллом.
Поэтому теллур может проявлять разные степени окисления: от −2 до +6 (наиболее характерны −2, +4 и +6).
Атомам теллура свойственна двойственная химическая природа: обладая высокой электроотрицательностью, он может притягивать электроны от металлов, но легко отдаёт их более активным неметаллам, таким как кислород или фтор.
Его электронная конфигурация [Kr] 4d10 5s2 5p4 определяет способность:
- Принимать два электрона для завершения внешнего уровня до стабильного октета (состояние −2);
- Отдавать до шести электронов при взаимодействии с сильными окислителями (состояния +4 и +6).
Нахождение теллура в 5‑м периоде делает его валентные электроны менее прочно связанными с ядром по сравнению с серой или кислородом.
Как определить степень окисления теллура
Определение степени окисления теллура (Te) — это базовая задача в химии, позволяющая понять роль этого полуметалла в конкретной химической реакции.
Теллур относится к 16-й группе (халькогены), что делает его химическое поведение схожим с серой и селеном, но с учетом более выраженных металлических свойств.
Чтобы правильно определить степень окисления, необходимо учитывать пять ключевых факторов:
- По таблице Менделеева (границы).
- По валентности (число связей).
- По химическому соединению (расчёт через X).
- По конфигурации (распаривание электронов).
- По электроотрицательности (знак заряда).
По таблице Менделеева (границы)
Этот метод позволяет мгновенно определить «рамки», за которые значения заряда теллура не могут выйти.
-
Высшая степень окисления: соответствует номеру группы — +6. Это ситуация, когда атом отдает все свои валентные электроны.
-
Низшая степень окисления: вычисляется по формуле «Номер группы минус 8» (6 − 8 = −2). Столько электронов нужно атому, чтобы заполнить свой внешний слой.
По валентности (число связей)
Валентность теллура — это количество химических связей, которые атом образует с другими атомами. У теллура она переменная:
-
Валентность II: соответствует степени окисления −2 (в соединениях с водородом и металлами, например, H2Te).
-
Валентность IV: самая стабильная. Дает степень окисления +4 (например, в диоксиде TeO2).
-
Валентность VI: соответствует высшей степени окисления +6 (например, в теллуровой кислоте H6TeO6).
По химическому соединению (расчёт через X)
Самый практичный метод, основанный на правиле: сумма зарядов всех атомов в молекуле равна 0.
-
Возьмем формулу TeO₂. Мы знаем, что у кислорода (O) степень окисления всегда −2.
-
Составляем уравнение: x + (2 · −2) = 0.
-
Решаем: x − 4 = 0 → x = +4.
По конфигурации (распаривание электронов)
Этот способ объясняет природу степеней окисления через квантовую химию.
Электронная формула внешнего слоя теллура — 5s2 5p4.
-
В обычном состоянии у него 2 неспаренных электрона (степень −2).
-
При возбуждении один электрон с p-подуровня переходит на свободный d-подуровень, образуя 4 неспаренных электрона (степень +4).
-
При максимальном возбуждении электроны с s-подуровня также распариваются, давая 6 одиночных электронов (степень +6).
По электроотрицательности (знак заряда)
Электроотрицательность (ЭО) определяет, в какую сторону смещаются электроны. У теллура ЭО ≈ 2.1.
-
Отрицательный знак (−): если теллур связан с элементами, у которых ЭО ниже (металлы, водород). Теллур сильнее притягивает электроны к себе.
-
Положительный знак (+): если теллур в паре с «сильными» неметаллами (фтор, кислород, хлор). Они забирают электроны у теллура, оставляя ему положительный заряд.
Почему и как теллур проявляет такие степени окисления
Способность теллура (Te) менять свой заряд зависит от того, сколько электронов он принимает или отдает для достижения стабильности.
На его внешнем слое находится 6 электронов (5s25p4).
Степень окисления −2
Атому теллура не хватает всего 2-х электронов до полного заполнения внешнего слоя (до конфигурации благородного газа).
Он проявляет эту степень при взаимодействии с элементами, которые легко отдают электроны (металлы и водород).
Примеры:
-
H2Te — теллуроводород
-
Na2Te — теллурид натрия
Степень окисления +4
Это самая стабильная степень для теллура. Она возникает, когда 4 электрона с p-подуровня участвуют в создании связей с сильными неметаллами.
При этом пара s-электронов остается «нетронутой» (эффект инертной пары), что делает такие соединения очень устойчивыми.
Примеры:
-
TeO2 — диоксид теллура
-
TeCl4 — тетрахлорид теллура
Степень окисления +6
Теллур задействует все свои 6 валентных электронов, включая s-пару.
Это происходит только в реакциях с самыми агрессивными окислителями (фтор, кислород в составе кислот), которые способны «вытянуть» все электроны с внешнего уровня на пустующие d-орбитали.
Примеры:
-
TeF6 — гексафторид теллура
-
H6TeO6 — теллуровая кислота
Степень окисления +2 (редкая)
Возникает при частичном распаривании электронов или в специфических условиях взаимодействия с галогенами, когда теллур отдает только два p-электрона.
Соединения обычно неустойчивы и склонны к распаду.
Примеры:
-
TeCl2 — дихлорид теллура
-
TeBr2 — дибромид теллура
| Степень | Химическая роль | Класс соединений | Примеры |
|---|---|---|---|
| −2 | Восстановитель | Теллуриды | H2Te, Na2Te |
| 0 | Окислитель / Восстановитель | Простое вещество | Te |
| +4 | Амфотерность | Диоксид, теллуриты | TeO2, Na2TeO3 |
| −2 | Окислитель | Теллураты, кислоты | TeF6, H6TeO6 |
Типичные окислительно-восстановительные реакции (ОВР)
Теллур меняет свою степень окисления в зависимости от силы партнёра по реакции.
Основные сценарии:
А) Теллур как восстановитель (повышение степени)
При взаимодействии с сильными окислителями (например, концентрированными кислотами) свободный теллур окисляется до +4:
Здесь теллур Te0 отдаёт 4 электрона, превращаясь в диоксид.
Б) Соединения Te(+4) как окислители
В промежуточной степени окисления теллур часто проявляет свойства окислителя, стремясь вернуться в состояние простого вещества (0):
Это классическая реакция выделения чистого теллура из растворов его солей.
В) Реакция диспропорционирования
В горячих щелочных растворах теллур может одновременно повышать и понижать степень окисления:
Теллур превращается в теллурид (−2) и теллурит (+4).
Г) Самый сильный окислитель для Теллура
Чтобы перевести теллур в высшую степень окисления +6, нужны очень мощные реагенты.
Единственный элемент, который легко делает это — фтор:
Фтор переводит теллур в максимальное состояние.
Пример решения, задача:
▶️ Дано:
Химическое соединение: K2TeO3 (Теллурит калия).
⌕ Найти:
Определите степень окисления (СО) теллура в соединении.
✨ Решение:
Расставим известные степени окисления: у Калия (K) она всегда +1 (металл I группы), у Кислорода (O) в оксисолях она -2.
Составим уравнение, учитывая, что молекула электронейтральна (сумма зарядов равна 0) : (+1 • 2) + x + (-2 • 3) = 0
Раскрываем скобки и решаем: 2 + x — 6 = 0
x — 4 = 0
x = +4
✅ Ответ:
Степень окисления теллура в соединении K2TeO3 равна +4.
Проверка знаний: Степени окисления Теллура (Te)
Выберите три утверждения, которые абсолютно верно описывают изменение зарядов атома теллура в химических реакциях.
По каким признакам можно определить степень окисления Теллура в соединениях?
Показать верные ответы и пояснения
Правильные ответы: 1, 3, 4
-
- 1) Диапазон от -2 до +6.
Верно. Как элемент VI группы, теллур может принять 2 электрона (до октета) или отдать все 6 валентных электронов. - 3) Степень окисления -2 в H2Te.
Верно. Водород менее электроотрицателен, чем теллур, поэтому он отдаёт свои электроны, заряжая теллур отрицательно. - 4) Высшая степень окисления +6.
Верно. Это соответствует номеру группы и полному опустошению внешнего энергетического уровня (5s2 5p4).
- 1) Диапазон от -2 до +6.
Часто задаваемые вопросы:
Самые характерные и стабильные степени окисления для теллура — это −2, +4 и +6.
При этом состояние +4 считается наиболее устойчивым в большинстве химических соединений, таких как диоксид теллура (TeO2).
Да, теллур может иметь степень окисления +2, например, в дихлориде (TeCl2) или дибромиде (TeBr2).
Однако такие соединения химически неустойчивы, легко окисляются или распадаются, поэтому в природе и технике они встречаются редко.
Чтобы «вытянуть» из атома теллура все 6 валентных электронов, нужен очень сильный окислитель.
Фтор и кислород обладают самой высокой электроотрицательностью.
Поэтому только они способны образовать с теллуром устойчивые соединения в высшей степени окисления, такие как гексафторид (TeF6) или теллуровая кислота (H6TeO6).