Теория:
Валентность и степень окисления фтора (F) это: способность атома фтора образовывать одну ковалентную связь с другим атомом (валентность).
И условный заряд атома фтора в соединении, рассчитанный из предположения, что все ковалентные полярные связи имеют ионный характер (степень окисления).
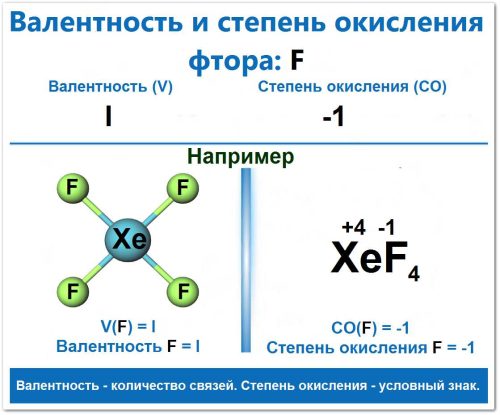
Поэтому фтор в своих соединения проявляет валентность I и степень окисления -1.
Исключением является только свободная молекула фтора (F2), где фтор, как и любой атом в простом веществе, имеет СО = 0.
В химических соединениях исключений для СО = -1 нет, кроме фторида кислорода (OF2) степень окисления фтора равна −1, а кислорода — +2.
Зависимость степени окисления от валентности
У фтора валентность и степень окисления жёстко связаны из‑за его уникальных свойств:
- Он самый электроотрицательный элемент (по шкале Полинга — 4,0);
- Его атом не имеет d‑орбиталей, поэтому не может переходить в возбуждённое состояние;
- На внешнем уровне — 7 электронов (конфигурация 1s22s22p5), до октета нужен только 1 электрон.
Из этого следует, что:
- Валентность всегда I (образует только одну ковалентную связь);
- Степень окисления почти всегда −1 (притягивает к себе электронную плотность).
Важно: положительных степеней окисления у фтора нет — он никогда не отдаёт электроны, а только принимает.
Валентность (V) фтора: почему она всегда I?
Валентность определяется числом неспаренных электронов и доступных орбиталей для образования связей.
У атома фтора:
- В основном состоянии — 1 неспаренный электрон (2p‑орбиталь);
- Нет свободных d‑орбиталей (в отличие от хлора, брома и йода);
- Невозможно «распарить» электроны и увеличить число неспаренных.
Поэтому:
фтор образует только одну ковалентную связь (например, в HF, F2, CF4);
валентность всегда I, даже в сложных соединениях.
Степень окисления (СО) фтора: почему почти всегда −1?
Степень окисления — это условный заряд атома в соединении, который вычисляют, предполагая, что все ковалентные полярные связи полностью ионны (т. е. электронная пара целиком «отдана» более электроотрицательному атому).
Для фтора степень окисления почти всегда равна −1
Фтор:
- Имеет наивысшую электроотрицательность.
- Всегда «перетягивает» электронную плотность на себя.
- В любом соединении приобретает заряд −1.
Примеры:
F2: СО = 0 (простое вещество);
HF: СО(F) = −1;
CaF2: СО(F) = −1;
CF4: СО(F) = −1.
Исключение: в гипотетических или крайне нестабильных соединениях (например, при взаимодействии с благородными газами) могут рассматриваться иные значения, но в школьной и базовой университетской химии их не учитывают.
Валентность и степень окисления на примере фтороводорода (HF)
Валентность атомов в HF
В молекуле HF:
Атом водорода (H) имеет 1 валентный электрон. Он образует одну ковалентную связь с фтором.
→ Валентность водорода = I.
Атом фтора (F) имеет 7 валентных электронов (конфигурация 2s22p5).
Ему нужен ещё 1 электрон для завершения внешнего слоя. Он образует одну ковалентную связь с водородом.
→ Валентность фтора = I.
Степень окисления атомов в HF
Степень окисления — условный заряд атома в соединении, рассчитанный из предположения, что все ковалентные полярные связи полностью ионны.
Чтобы определить степени окисления в HF, учтём:
Электроотрицательность (ЭО) фтора = 4,0 (самая высокая среди всех элементов).
Электроотрицательность водорода = 2,1.
Связь H–F сильно полярна: электронная плотность смещена к фтору.
СО(H) + СО(F) = 0
По правилу электроотрицательности:
- более электроотрицательный атом (F) получает отрицательный заряд;
- менее электроотрицательный (H) — положительный.
Присваиваем:
СО(F) = −1 (фтор «забирает» электронную пару);
СО(H) = +1 (водород «отдаёт» свой электрон).
Проверка:
(+1) + (−1) = 0
Вывод:
Степень окисления фтора в HF = −1.
Степень окисления водорода в HF = +1.
Пример решения, задача:
▶️ Дано:
Соединение гексафторид ксенона (XeF6)
⌕ Найти:
Определите валентность (V) и степень окисления (СО) в соединении.
✨ Решение:
Валентность Фтора (F) всегда равна I (единице) в соединениях, так как он имеет только один неспаренный электрон и не может возбуждаться (нет d-орбиталей).
V(F) = I
Определение СО(F):
Фтор является самым электроотрицательным элементом. Он всегда «перетягивает» электронную плотность, стремясь принять один электрон для завершения оболочки.
СО(F) = -1
✅ Ответ:
Его валентность равна I, степень окисления -1.
Часто задаваемые вопросы:
У атома фтора 1 неспаренный электрон (конфигурация 2s22p5).
Нет свободных d‑орбиталей → нельзя «распарить» электроны и увеличить число связей.
Образует только одну ковалентную связь во всех соединениях.
Фтор — самый электроотрицательный элемент (4,0 по Полингу) → притягивает электронную плотность.
Для завершения внешнего слоя ему нужен 1 электрон → СО = −1.
Исключение: в простом веществе F₂ степень окисления = 0.
Положительных степеней окисления у фтора нет.
Валентность: H = I (1 связь); F = I (1 связь).
Степень окисления: H = +1 (отдаёт электрон); F = −1 (притягивает электрон).
Связь: H–F (одинарная ковалентная, полярная).

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.