Te теллур [Tellurium; от лат. tellus (telluris) — Земля] — химический элемент 16-й группы с порядковым номером 52 в периодической системе.
Атомный номер 52, атомная масса 127,60. Находится в пятом периоде. Температура плавления: 449.6 ℃, температура кипения 988 °С. Плотность: 6.25 г/см3.
Электронная формула
Полная электронная формула атома теллура в порядке следования уровней:
1s2 2s2 2p6 3s2 p6 3d10 4s2 4p6 4d10 5s2 5p4
Сокращенная электронная конфигурация Te:
[Kr] 4d10 5s2 5p4
Электронная формула атома теллура в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p4
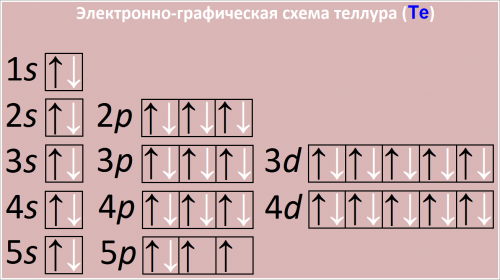
Электронно-графическая схема теллура (Te)
Рис. Схема распределения электронов по атомным орбиталям в атоме теллура.
Энергетические уровни
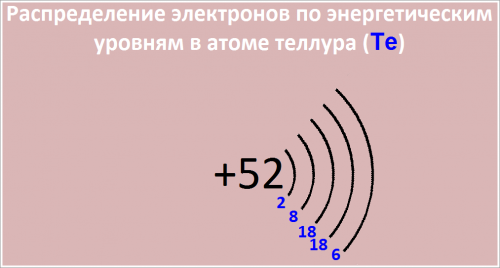
Распределение электронов по энергетическим уровням в атоме Te:
- -й уровень (K): 2
- -й уровень (L): 8
- -й уровень (M): 18
- -й уровень (N): 18
- -й уровень (O): 6
Рис. Распределение электронов по энергетическим уровням в атоме теллура.
Валентные электроны теллура
Количество валентных электронов в атоме — 6.
Таблица квантовых чисел Те (N — главное, L — орбитальное, M — магнитное, S — спин).
| Орбиталь | N | L | M | S |
| s | 5 | 0 | 0 | +1/2 |
| s | 5 | 0 | 0 | -1/2 |
| p | 5 | 1 | -1 | +1/2 |
| p | 5 | 1 | 0 | +1/2 |
| p | 5 | 1 | 1 | +1/2 |
| p | 5 | 1 | -1 | -1/2 |
В соединениях теллур проявляет степень окисления: -2, +2, +4, +5, +6.
Стабильные изотопы
| Изотоп | Протоны | Нейтроны | Атомная масса изотопа |
| 120Te | 52 | 68 | ~119.90402 |
| 122Te | 52 | 70 | ~121.9030439 |
| 123Te | 52 | 71 | ~122.90427 |
| 124Te | 52 | 72 | ~123.9028179 |
| 125Te | 52 | 73 | ~124.9044307 |
| 126Te | 52 | 74 | ~125.9033117 |
| 128Te | 52 | 76 | ~127.9044631 |
| 130Te | 52 | 78 | ~129.9062244 |
Природный теллур состоит из восьми стабильных изотопов с массовыми числами: 120Te, 122Te, 123Te, 124Te, 125Te, 126Te, 128Te и 130Te.
Известны 16 радиоактивных изотопов с периодом полураспада от 2 до 154 дней. Наиболее распространены тяжелые изотопы с массовыми числами 128Te и 130Te.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.