Теория:
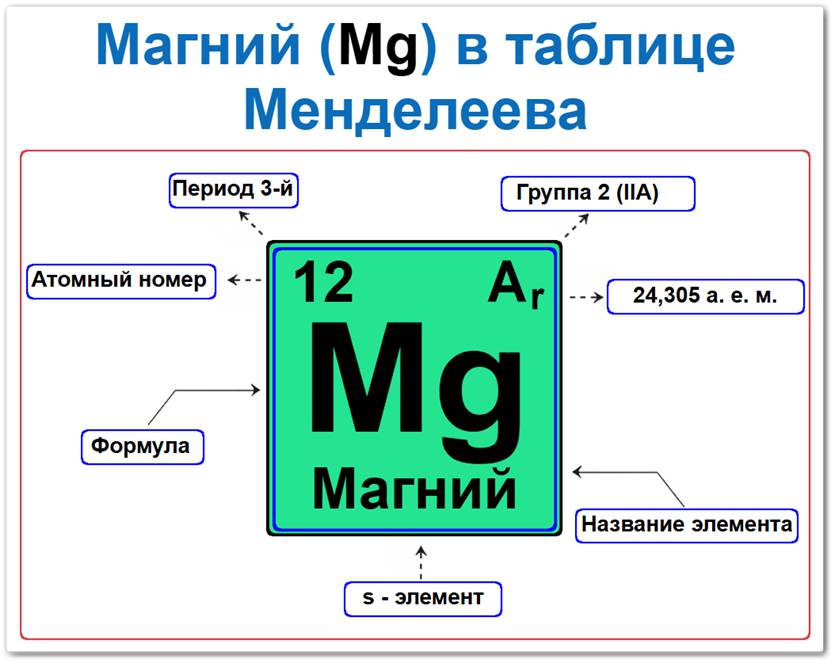
Магний (Mg) в периодической системе: 3‑й период, 2‑я группа (по устаревшей классификации — II A), атомная масса 24,305 а.е.м.
Занимает положение в 3‑м периоде, что определяет его принадлежность к s-элементам и группе щелочноземельных металлов.
Магний — один из самых распространенных элементов в земной коре. Он содержится в огромных количествах в морской воде, а также в минералах, таких как магнезит и доломит.
В свободном виде в природе не встречается из-за высокой химической активности. При поджигании на воздухе магний горит ослепительно белым пламенем, превращаясь в оксид.
Будучи типичным элементом s-блока, он располагается в левой части таблицы Менделеева, находясь под бериллием и над кальцием.
Магний значительно мягче бериллия, но тверже последующих элементов своей группы.
Нахождение Магния во 2‑й группе и наличие двух валентных электронов обуславливают его ключевые параметры:
Постоянную валентность II.
А также критическую роль в биологии (центр молекулы хлорофилла) и промышленности (сверхлегкие сплавы для авиации, автомобилестроения и мобильной электроники).
Структура атома подтверждается его электронной формулой (конфигурацией):
1s2 2s2 2p6 3s2 (или [Ne] 3s2).
На которой наглядно можно определить его положение как s-блочного элемента, у которого заполняется внешний 3s-подуровень.
Магний — элемент таблицы Менделеева, который можно определить на основании закона периодичности: положение в ряду щелочноземельных металлов период 3, группа 2, а также по его порядковому номеру (Z = 12).
Как определить положение Магния в Таблице Менделеева
Локация магния в таблице описывается характеристиками его атомного ядра — его «химическим аттестатом» (паспортом):
- Порядковый номер (атомный номер).
- Наименование (название) элемента.
- Группа (2-я группа, подгруппа магния).
- Период (горизонтальный ряд).
- Электронное семейство (магний — s‑элемент).
Порядковый номер / атомный номер (Z = 12)
- Служит уникальным кодом элемента в системе.
- В ядре — 12 протонов; в нейтральной оболочке — 12 электронов.
- Электронное строение: 2, 8, 2.
Важно: Магний называют «металлом жизни». Без него невозможен фотосинтез, так как он занимает центральное место в молекуле хлорофилла, точно так же, как железо в гемоглобине нашей крови.
Название и символ
- Название: «магний» (от названия древнегреческого города Магнезия).
- Символ: Mg (Magnesium).
- Примечание: Это очень легкий металл (в 1.5 раза легче алюминия). В чистом виде он довольно активен, но изделия из него защищены тонкой оксидной пленкой.
Группа (2 / II A)
Расположен во 2‑й группе. В периодической системе магний находится между бериллием (Be) и кальцием (Ca), являясь эталоном для своей подгруппы (подгруппа магния).
Химический потенциал:
- Валентность магния: всегда II.
- Степень окисления магния: +2. Оксид и гидроксид магния проявляют только основные свойства (в отличие от амфотерного бериллия).
Период (3‑й)
Находится в 3‑м периоде — это означает, что его электроны располагаются на трех энергетических уровнях.
Влияние на свойства:
- Химическая активность: Выше, чем у бериллия. Магний медленно реагирует с горячей водой и быстро — с кислотами.
- Техническое значение: Магниевые сплавы незаменимы там, где важен малый вес — от корпусов ноутбуков до деталей гоночных болидов.
Все значения элементов в полной сводной таблице параметров химических элементов.
Относительная атомная масса (Ar)
- Ar(Mg) ≈ 24,305 а.е.м.
- Определение: Природный магний состоит из смеси трех стабильных изотопов (24, 25 и 26).
Все значения для всех элементов можно узнать в таблице атомных масс.
s‑Элемент (электронное семейство)
Заполняется внешний 3s‑подуровень (3s2).
Специфика блока: Имея два электрона на внешнем уровне, магний легко их отдает, превращаясь в ион Mg2+ с устойчивой оболочкой инертного газа неона.
Определение энергетических уровней Магния по Таблице Менделеева
Положение Магния (Mg) дает четкое представление о его архитектуре.
1. 3-й период (Количество слоев)
- Итог: У Магния 3 энергетических уровня.
2. Распределение электронов
Атомный номер Магния — 12. Распределение электронов по слоям:
Mg ) 2 ) 8 ) 2
3. 2-я группа (Химический характер)
- s-элемент: Два валентных электрона делают его сильным восстановителем.
- Металлические свойства: Серебристо-белый, легкий, ковкий металл.
Проверка знаний: Как определить магний по таблице Менделеева
Выберите три верных тезиса, которые однозначно характеризуют Магний (Mg).
Показать верные ответы и пояснения
Правильные ответы: 1, 2, 3
- 1) Номер 12. Соответствует заряду ядра.
- 2) 3-й период, 2-я группа. Точное положение в системе.
- 3) s-элемент. Так как заполняется s-подуровень внешнего уровня.
- 4) Ошибка. Магний — активный металл.
- 5) Ошибка. Для магния характерна валентность II.
Часто задаваемые вопросы:
Он расположен в 3-м периоде, 2-й группе. Порядковый номер — 12.
Магний (Mg) относится к главной подгруппе II группы (или ко 2-й группе по современному стандарту IUPAC).
У магния 2 валентных электрона на внешнем (третьем) слое. Конфигурация: …3s2.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.