Теория:
Валентность и степень окисления Бора (B) — это способность элемента образовывать химические связи и приобретать соответствующий условный заряд в соединениях.
Это полуметалл из III группы, который наглядно демонстрирует, как постоянная основная валентность может приводить к переменной степени окисления из-за его амфотерной (двойственной) природы.
Поэтому в абсолютном большинстве соединений Бор проявляет постоянную валентность III (три).
Степень окисления в стабильных соединениях не фиксирована, а переменна и зависит от соседа:
СО = +3: Проявляется в соединениях с более электроотрицательными неметаллами (например, B2O3, BF3), где Бор отдает свои три электрона.
СО = -3 (-1, -2): Проявляется в соединениях с менее электроотрицательными металлами (например, в боридах), где Бор принимает электроны.
Таким образом, Бор может выступать как отдающий (+3) и как принимающий (от -1 до -3) электроны, что и создает широкий диапазон его СО при стабильной валентности III.
Зависимость степени окисления от валентности бора
Для бора (B) зависимость между численным значением степени окисления и валентности непрямая и переменная, поскольку бор является полуметаллом, который может как отдавать, так и принимать электроны.
Его электронная конфигурация — 1s2 2s2 2p1. На внешнем уровне находится 3 электрона. Бор может отдать все три электрона или принять электроны для достижения стабильности.
Валентность (III) создает структурную основу — она определяет, что Бор в большинстве соединений всегда образует три связи BF3.
Степень окисления (+3, -3, -2, -1) реализует эту возможность в виде условного заряда, который зависит от соседа бора:
- Если B связан с неметаллами (как O или F), он отдает электроны, и его СО становится положительной (+3).
- Если B связан с металлами (как Mg), он принимает электроны, и его СО становится отрицательной (-1 до -3).
Таким образом, численное значение валентности (3) совпадает с максимальным численным значением СО (3), но в отличие от Бериллия, СО Бора переменна и может быть как положительной, так и отрицательной (например, в B2O3 V = III и СО = +3; в MgB2 V = III и СО = -2).
Валентность (V) бора
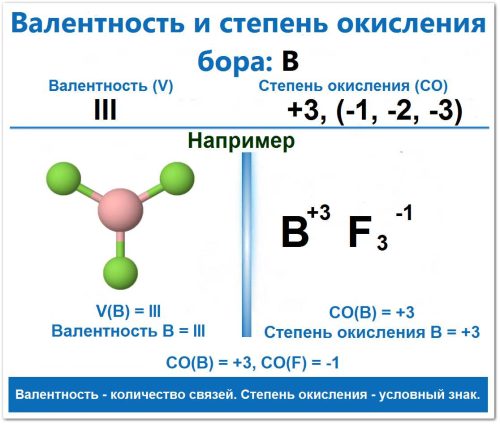
Валентность Бора (то есть, число химических связей, которые он может образовать) в подавляющем большинстве его соединений постоянна и равна III (трем).
Это обусловлено тем, что атом Бора находится в III группе и имеет три внешних электрона (2s2 2p1).
Для достижения стабильного состояния (октета, или восьми электронов на внешнем уровне) он всегда стремится использовать все эти три электрона для образования именно трех связей.
➡️ Валентность III (Три)
Используются три внешних электрона для формирования трех связей.
Три одинарные связи:
Пример: В трифториде бора (BF3). Бор связан с тремя атомами фтора.
Одна двойная и одна одинарная связь:
Пример: В борной кислоте (H3BO3). Атом Бора связан с тремя кислородами (B—O, B—O, B=O в резонансной структуре).
➡️ Исключение: Валентность IV (Четыре)
В отличие от Бериллия, Бор может выступать в качестве акцептора электронной пары, поскольку имеет свободную p-орбиталь (незавершенный октет).
Это позволяет ему образовать четвертую связь по донорно-акцепторному механизму при образовании комплексных анионов, таких как тетрафтороборат-ион (BF4).
Валентность Бора, таким образом, в подавляющем большинстве его соединений равна III (трем), но может увеличиваться до IV (четырех) за счет образования дополнительных связей.
Степень окисления (СО) бора
Степень окисления показывает условный заряд атома, предполагая ионные связи.
Фтор (F): Является самым электроотрицательным элементом, всегда принимает один электрон.
СО(F) = -1
Бор (B): Так как F более электроотрицателен, чем B, Бор отдает три электрона, чтобы компенсировать три атома F (так как (+3) + 3 х (-1) = 0).
СО(B) = +3
✅ Обозначение
Показатель степени окисления над формулой:
B+3F3-1
Степень окисления Бора (условный заряд) прямо связана с его валентностью (III), но из-за его амфотерной природы (находится на границе металлов и неметаллов).
И средней электроотрицательности, она переменна и может быть как положительной, так и отрицательной.
Бор является полуметаллом, который может как отдавать свои три валентных электрона, так и принимать электроны.
➡️ СО = +3: Основное положительное состояние
Это наиболее устойчивое и распространенное положительное состояние Бора, которое возникает, когда Бор связан с более электроотрицательными неметаллами.
Это основное состояние, в котором Бор отдает три электрона (3e—).
Пример: В оксиде бора (B2O3).
СО (B) = +3, СО(O) = -2
Пример: В трифториде бора (BF3).
СО (B) = +3, СО (F) = -1
➡️ СО = -1, -2, -3: Отрицательные состояния
Эти состояния характерны для боридов — соединений с менее электроотрицательными металлами, где Бор выступает в роли неметалла, принимая электроны.
СО = -2: Например, в бориде магния (MgB2) .
СО = -3: Наивысшее отрицательное значение, возникающее при принятии трех электронов.
Таким образом, для целей химии +3 — это самое распространенное значение СО для Бора, но диапазон -3 до +3 отражает его истинную химическую гибкость.
Валентность и степень окисления бора на примере
Валентность (V)
Валентность показывает количество химических связей, которые образует атом.
Бор (B): В BF3 атом бора связан с тремя атомами Фтора.
Это соответствует его положению в III группе и использованию трех внешних электронов для образования связей.
Фтор (F): Атом Фтора всегда образует одну связь.
Структура: Молекула BF3 имеет форму плоского треугольника с тремя одинарными связями.
Степень Окисления (СО)
Степень окисления показывает условный заряд, который атом приобретает из-за смещения электронов (полярности связей).
Фтор (F): Фтор — самый электроотрицательный элемент. Он всегда принимает один электрон в соединениях.
Бор (B): Определяется из условия нейтральности: СО B + 3 СО (F) = 0.
Пример решения, задача:
▶️ Дано:
Соединение BF3 (Трифторид бора)
⌕ Найти:
Определите валентность (V) и степень окисления (СО) в соединении.
✨ Решение:
Валентность (V)
Валентность показывает количество химических связей, которые образует атом.
Бор (B): В BF3 атом Бора связан с тремя атомами Фтора. Валентность (B) = III (Три связи).
Фтор (F): Атом Фтора всегда образует одну связь. Валентность (F) = I (Одна связь).
Степень окисления (СО)
Степень окисления показывает условный заряд, исходя из электроотрицательности.
Фтор (F): Является самым электроотрицательным элементом, его СО всегда -1. СО(F) = -1
Бор (B): Определяется из условия нейтральности (СО (B) + 3 × СО (F) = 0):
СО (B) + 3 × (-1) = 0, следовательно СО (B) = +3
✅ Ответ:
Его валентность равна III, степень окисления +3.
Часто задаваемые вопросы:
Обычно проявляет валентность III и степень окисления +3 в своих соединениях.
Наиболее стабильным состоянием для него является степень окисления +3.
Валентность: показывает количество химических связей (обычно III).
Степень окисления: показывает условный заряд атома (обычно +3).

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.