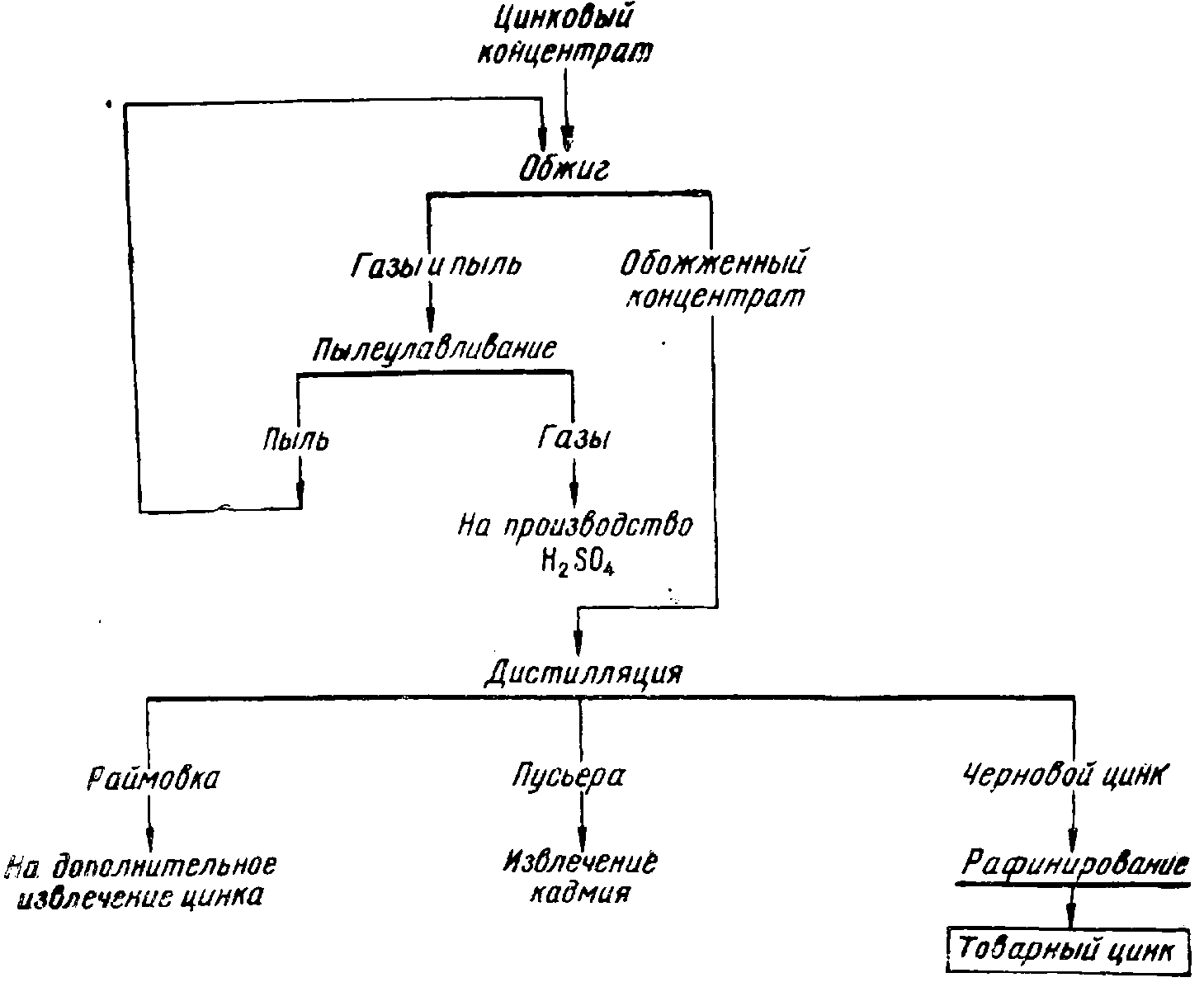
Существуют два метода извлечения цинка из концентратов: пирометаллургический (дистилляционный) и гидрометаллургический (электролитический).
В пирометаллургическом процессе оксид цинка восстанавливают до металлического состояния при использовании углерода и сопровождают его температурой от 1000 до 1100 °C. Кипение полученного цинка возникает при температуре 906 °C.
Реакция восстановления сопровождается выделением газообразного цинка, который затем подвергается дистилляции. Пустые компоненты остаются в твёрдом состоянии. Путем конденсации паров можно получить жидкий металлический цинк.
Что такое получение цинка дистилляцией
Некоторые авторы, не ссылаясь на достоверные источники, сообщают о получении чистого цинка в Индии и Китае еще в V в. до н. э.
Наряду с этим Аристотель упоминает лишь о латуни как о медном сплаве неизвестного состава, который мог быть получен восстановительной плавкой медно-цинковой руды.
Свойства соединений цинка — впервые описал Парацельс (XVI в.). Получение металла дистилляцией из галмея (смесь смитсонита и каламина) разработал А. С. Маргграф в начале XVIII в.
Далее Д. Чемпион в 1739 г. получил патент на способ производства цинка из окисленных руд, а в сороковых годах того же столетия построил завод с производительностью около 200 т/год.
Общая схема дистилляционного способа производства цинка показана на рис.
Рис. Общая схема получения цинка дистилляцией из твердой шихты
Восстановление цинка твердым углеродом протекает через газовую фазу и слагается из двух реакций:
ZnO + СО = Zn + СО2,
СО2 + С = 2СО,
ZnO + С = Znnap + СО, ΔH0298= 238 кДж.
Равновесие суммарной реакции, достигаемое при температуре несколько выше 900° С, мало зависит от парциального давления СО и СО2
Равновесное состояние неприемлемо для производства, его необходимо сдвинуть вправо, повышая температуру и отведя конденсацией пары цинка.
Из уравнения видно, что рZn = рCO, приближенным вычислением получены следующие данные:
Температура, °С … . 927 1027 1327
pZn, кН/м2 …… 91,2 124,4 860,0
Давления на первый взгляд кажутся невероятно высокими, однако зона реакции сообщается с конденсатором, где пары цинка ожижаются, а газы удаляются в атмосферу.
Эндотермичность восстановления вызывает необходимость постоянного подвода тепла от источника, который, естественно, должен иметь более высокую температуру.
Сжигать топливо в реакционном пространстве нельзя из-за окисления и разбавления паров металла дымовыми газами. Приходится передавать тепло через стенку, разность температур на поверхностях которой 50—100 град.
Механическая прочность огнеупорных материалов при 1400° С уже заметно снижается, и нагревать шихту выше 1200—1300° С трудно. Скорость восстановления цинка контролируется диффузией СO2 к поверхности углерода.
Она зависит от температуры и теплопередачи, которая с уменьшением интервала температур снижается почти независимо от способа поступления теплоты через шихту или конвекцией.
В конечном счете кинетика дистилляции определяется скоростью подвода тепла.
Примеси
Железо, медь, свинец и многие другие металлы в условиях дистилляции цинка также восстанавливаются, примем образование FeO подобно образованию ZnO эндотермично.
Присутствие окислов железа, которых в сравнении с другими примесями, всегда много, замедляет восстановление, отнимая необходимое тепло, и разбавляет пары цинка дополнительным количеством СО.
Примеси свинца и кадмия не только восстанавливаются, но испаряются и конденсируются вместе с цинком; металл, получаемый дистилляцией, загрязнен этими элементами.
Его необходимо рафинировать для улучшения свойств и извлечения примесей, особенно дорогого кадмия.
Конденсация цинка
Охлаждение газов, необходимое для конденсации цинка, сопровождается диспропорционированием СО на углекислоту и сажистый углерод.
Возникающие при этом взвешенные мелкие капли металла, покрываясь с поверхности слоем ZnO, ZnCО3 и сажи, теряют способность сливаться.
Они выносятся газами в зону сравнительно низких температур и затвердевают, образуя пусьеру.
Перед дистилляцией ZnS надо полностью окислить: сульфат цинка тоже % не восстанавливается, а вновь переходит в сульфид:
ZnSО4 + 4СО = ZnS + 4СО2
Кроме того, необходимое условие реакции — контакт СО со свободной поверхностью окиси цинка, огарок должен быть легко проницаем для газов.
Обжигом в многоподовых печах или печах КС удается полностью выжечь серу, но шихта получается мелкой и ложится плотным слоем.
Агломерация дает пористый гозопроницаемый спек, но в нем остается сера.
Учитывая эти требования огарок получают в две стадии: концентрат обжигают в печах КС на порошок, оставляя немного серы.
Затем его смешивают с оборотным агломератом и спекают на спекательных машинах. Для увеличения объемной массы кусковой спек измельчают до крупности около 1 мм.
Полученные таким образом мелкие пористые частицы направляют на дистилляцию. Дополнительная газопроницаемость шихты достигается смешиванием огарка с зернистым углем-восстановителем.
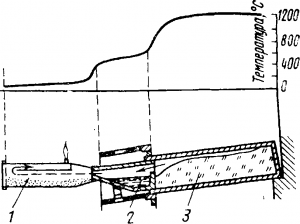
Рис. 2. Схема установки для дистилляции цинка в горизонтальной реторте:
1 — алонжа; 2 — конденсатор; 3 — реторта
Дистилляция в горизонтальных ретортах
Смесь обожженного концентрата с антрацитом или коксовой мелочью загружают в реторты из шамота (рис. 2). К устью каждой из них примазан глиной керамический конденсатор, из которого периодически вычерпывают жидкий цинк.
Из-за большой скорости газов, медленного отвода тепла и по другим причинам, о которых сказано ниже, часть паров металлов проходит через конденсатор; ее улавливают в железной алонже в виде пусьеры.
После окончания дистилляции, длящейся до 18 ч, конденсатор и алонжу снимают, а из реторты выгребают остаток — раймовку.
В последней содержится еще 6—12% цинка, который дополнительно извлекают особой переработкой.
Работы по выгрузке и загрузке реторт, требующие суммарно около 6 ч, на заводе называют маневром, вместе с ним цикл-дистилляции составляет 24 ч.
Попытки изменить форму и увеличить емкость горизонтальных реторт, подобрать для них другой —более прочный и теплопроводный материал, укрупнить конденсаторы, соединив их с несколькими ретортами, приносили лишь небольшие частные успехи без коренного усовершенствования передела.
Быстрые ответы?
Так как цинк как самородный металл в природе не встречается. Добывается из полиметаллических руд, содержащих 1–4% металла в виде сульфида, а также меди, свинца, золота, серебра, висмута и кадмия.
С помощью пирометаллургический (дистилляционный) и гидрометаллургический (электролитический) реакции.
Основные примеси которые содержаться в материале: железо, медь, свинец, а также некоторые другие.

Добавить комментарий
Для отправки комментария вам необходимо авторизоваться.